下列热化学方程式中,正确的是
| A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ·mol-1 |
B.由N2(g)+3H2(g) 2NH3(g)△H=-92.4 kJ·mol-1热化学方程式可知, 当反应中转移6NA电子时,反应放出的热小于92.4 kJ 2NH3(g)△H=-92.4 kJ·mol-1热化学方程式可知, 当反应中转移6NA电子时,反应放出的热小于92.4 kJ |
| C.HCl和NaOH反应的中和热△H="-57.3" kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1 |
| D.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ·mol-1 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.无色溶液中:K+、Na+、Cu2+、SO42- |
| B.c(OH-)=10-13 mol·L-1的溶液中:Al3+、NO3-、I-、Cl- |
| C.水电离产生的c(H+)=10-13 mol·L-1的溶液中:Na+、Cl-、NO3-、SO42- |
| D.0.1 mol·L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO- |
下列有关化学用语表示不正确的是
A.氧的原子结构示意图: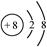 |
B.Na2O2的电子式: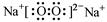 |
| C.HClO的结构式:H-O-Cl |
D.中子数为16的硫离子: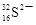 |
2012年世界环境日中国主题是:绿色消费,你行动了吗?下列做法不符合该主题的是
| A.开发利用太阳能、生物质能等清洁能源 |
| B.推广垃圾的分类回收,研发各种材料再生技术 |
| C.减少对化石燃料的依赖,有效降低PM2.5对环境的污染 |
| D.充分开发利用纯天然纤维,停止使用各种化学合成材料 |
将7.8g Na2O2和2.7g Al同时放入一定量的水中,充分反应后得到100mL溶液,再向该溶液中缓慢通入HCl气体3.36L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是
| A.反应过程中得到3.36L(标准状况)的气体 |
| B.反应结束得到3.9g的沉淀 |
| C.反应结束得到的溶液中c(Na+)= c(Cl-)+ c(OH-) |
| D.反应结束得到的溶液中c(NaCl)="1.0" mol·L-1 |
电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0-6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水作用。其原理如图所示。下列说法正确的是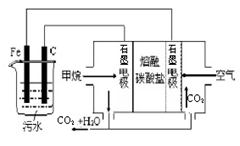
| A.铁电极为阳极,反应式为:Fe-3e-= Fe3+ |
| B.通入甲烷的石墨电极作负极,反应式为:CH4+8OH--8e-=CO2+6H2O |
| C.为增强污水的导电能力,可向污水中加入适量乙醇 |
| D.若阴极产生了44.8L气体,则理论上消耗同条件下的甲烷为11.2L |