向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
| A.Cu与Cu2O 的物质的量之比为2:1 |
| B.硝酸的物质的量浓度为2.6mol/L |
| C.产生的NO在标准状况下的体积为4.48L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
下列轨道表示式所表示的元素原子中,其能量处于最低状态的是( )
A.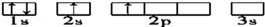 |
B.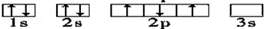 |
C. |
D.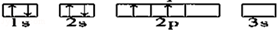 |
X、Y、Z、M四种金属,已知X可以从Y的盐溶液中置换出Y:X和Z作原电池电极时,Z为正极;Y和Z的离子共存于电解液中,Y离子先放电;M的离子的氧化性强于Y的离子.则这四种金属的活动性由强到弱的顺序为( )
| A.X>Y>Z>M | B.X>Z>M>Y | C.M>Z>X>Y | D.X>Z>Y>M |
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )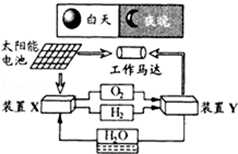
| A.该系统中只存在3种形式的能量转化 |
| B.装置Y中负极的电极反应式为:O2+2H2O+4e﹣=4OH﹣ |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
用指定的阳极和阴极电解一定组成的P溶液,然后加入一定量物质Q,能使溶液恢复到原来组成的P溶液的正确组合是( )
| 组别 |
阳极 |
阴极 |
P溶液 |
物质Q |
| A |
Ag |
Cu |
AgNO3溶液 |
AgNO3固体 |
| B |
C |
Cu |
CuSO4溶液 |
CuO |
| C |
Pt |
Pt |
NaOH溶液 |
NaOH固体 |
| D |
C |
Fe |
NaCl溶液 |
HCl气体 |
A.A B.B C.C D.D
某原电池装置如图所示.下列有关叙述中,正确的是( )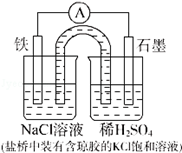
| A.Fe作正极,发生氧化反应 |
| B.负极反应:2H++2e﹣=H2↑ |
| C.工作一段时间后,两烧杯中溶解pH均不变 |
| D.工作一段时间后,NaCl溶液中c(Cl﹣)增大 |