某溶液可能含有Cl–、SO42–、CO32–、NH4+、Fe2+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0. 02 mol气体,同时产生沉淀;过滤、洗涤、灼烧,得到1.6 g红棕色固体;向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
| A.至少存在4种离子 |
| B.Cl– 一定存在,且c(Cl )≥0.4 mol/L |
| C.SO42–、NH4+,一定存在,Cl–可能不存在 |
| D.CO32–、Al3+ 一定不存在,K+可能存在 |
国外试行用“汽水”(碳酸饮料)浇灌植物,它的作用是( )
①对植物的呼吸作用有利
②改良碱性土壤,调节pH
③有利于土壤中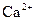 ,
, ,被植物吸收
,被植物吸收
④加速光合作用的进行
| A.②③④ | B.②④ | C.② | D.①②③④ |
X,Y,Z三种气体,把a molX和b molY充入一密闭容器中,发生反应:X+2Y 2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
A.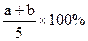 |
B.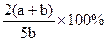 |
C.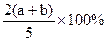 |
D.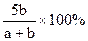 |
下列各分子中,所有原子都满足最外层为8电子结构的是( )
A.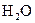 |
B.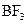 |
C.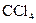 |
D.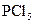 |
下列各溶液中,微粒物质的量浓度关系正确的是( )
A.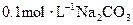 溶液中 溶液中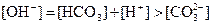 |
B.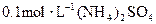 溶液中: 溶液中: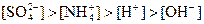 |
C.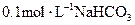 溶液中: 溶液中: |
D.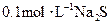 溶液中: 溶液中: |
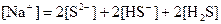
已知某溶液中存在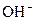 ,
,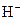 ,
, 和
和 四种离子,其浓度大小有如下关系,其中可能的是( )
四种离子,其浓度大小有如下关系,其中可能的是( )
①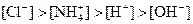
②
③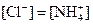 且
且
④
⑤
| A.①④ | B.③⑤ |
| C.①②③ | D.④⑤ |