下列说法或表示方法正确的是( )
| A.测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH的起始温度和反应结束后稳定的温度 |
| B.31g红磷变成31g白磷要吸收能量,说明白磷比红磷更稳定 |
| C.在101 kPa时,已知氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(g) ΔH=-571.6 kJ/mol |
| D.2A (l) + B (l) =" 2C" (l) △H1 2A (g) + B (g) =" 2C" (l)△H2 则ΔH1>ΔH2 |
2SO2(g)+O2(g) 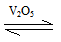 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
| A.催化剂V2O5增加该反应的正反应速率而不改变逆反应速率 |
| B.增大反应体系的压强,反应速率一定增大 |
| C.进入接触室的SO2和空气必须进行净化,且该反应不需要在高压下进行 |
| D.该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
下列实验设计和结论相符合的是
| A.将碘水倒入分液漏斗,加入适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| B.某气体能使湿润的红色石蕊试纸变蓝,该气体一定显碱性 |
| C.在蒸馏水中加入少量FeCl3固体,可得纯净的FeCl3溶液 |
| D.某无色溶液中加入Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
在下列给定条件的溶液中,一定能大量共存的离子组是
| A.无色溶液:Ca2+、H+、C1-、HSO3- |
B. =1×10-9mol·L-1的溶液:Na+、K+、SiO32-、NO3- =1×10-9mol·L-1的溶液:Na+、K+、SiO32-、NO3- |
| C.Na2CO3溶液:K+、Na+、SO42-、[Al(OH)4]- |
| D.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- |
下列叙述正确的是
| A.将CO2通人BaCl2溶液中至饱和,产生沉淀 |
| B.在稀硫酸中加入铜粉,铜粉不溶解,再加入KNO3固体,铜粉仍不溶解 |
| C.在KI溶液中加入NaNO2,没有明显现象,加入盐酸,立即有I2生成 |
| D.纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,速率不改变 |
下列选项错误的是
| A.在NH4C1晶体中含有离子键和共价键 |
| B.设想把“H2+Cl2 |
| C.某反应△H>0,△S>0,该反应是个非自发反应 |
| D.25℃时,NaNO2溶液的pH=8,c(Na+)-c(NO2-)=9.9×10-7mol·L-1 |