(1)Fe3+可以与SCN-、CN-、F-、有机分子等形成很多的配合物。
①写出基态Fe3+的核外电子排布式 。
②已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为 。
③下图是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示)。
④F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如下图)。该晶体的化学式为 。

(2)氨气是一种重要的化工原料。
①液氨和水类似,也能发生电离:NH3+NH3 NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度
NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度
为 。
②已知:N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-l
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-908 kJ·mol-l
写出氨气被一氧化氮氧化生成氮气和气态水的热化学方程式: 。
(3)在下图装置中,若通电一段时间后乙装置左侧电极质量增加。
①下列说法错误的是 ;
| A.乙中左侧电极反应式:Cu2++2e-=Cu |
| B.电解一段时间后,装置丙的pH减小 |
| C.向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 |
| D.电解一段时间后,向乙中加入0.1molCu(OH)2可使电解质溶液复原,则电路中通过的电子为0.2mol②若将甲中溶液换成MgCl2,则电解总反应的离子方程式为; |
③若Cu电极上质量增加2.16 g, 甲溶液体积为200mL, 则甲溶液的pH= 。
用系统命名方法命名下列各有机化合物
(1) (CH3)2CHCH(CH3)2 ______________________________;
(2)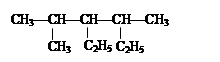 ______________________________;
______________________________;
有机物A为链烃类化合物,质谱图表明其相对分子质量为70,其相关反应如下图所示,其中A、B的结构中均含有2个—CH3,它们的核磁共振氢谱中均出现4个峰。
请回答:
(1)A的分子式为;
(2)B中所含的官能团为;C的结构简式为:
(3)I的反应类型为;
(4)写出反应Ⅰ的化学方程式:;
(5)请任写两种A的同分异构体的结构简式:
(6)A的同分异构体中有一对互为顺反异构,且结构中有2个—CH3,它们的结构简式为
和。
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) C(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| C(N2O4) |
0.20 |
a |
0.10 |
c |
d |
e |
| C(NO2) |
0.00 |
0.12 |
b |
0.22 |
0.22 |
0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
请回答下列问题:
(1)该反应的化学方程式为,正反应是(填“吸热”或“放热”)反应。
(2)20s时,N2O4的的浓度为mol/L,0~20s内N2O4的平均反应速率为。
(3)在80℃时该反应的平衡常数K值为(保留2位小数)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时。
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
由于NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须经处理后才能排放。处理方法之一的原理如下:
(1)请完成并配平该化学方程式。
(2)在上述反应中,若要生成50.8 g I2,则电子转移了________个。
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是
________________________________________________________________________。
从环保角度来讲,要处理NaNO2,所用物质的________(填“还原性”或“氧化性”)应该比KI更______(填“强”或“弱”)。
将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸中。向所得溶液中滴加5.0mol/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如右图所示。求: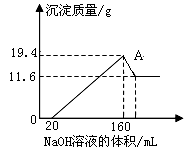
(1)A点沉淀物的化学式为 _。
(2)原合金中的Mg 、Al质量各多少克?
(3)盐酸的物质的量浓度。