下列各组物质充分反应后,最终既有沉淀又有气体生成的共有多少组? ( )
①少量Na2O2投入Ca(HCO3)2溶液中
②过量Ba(OH)2溶液和NH4HSO4溶液混合加热
③NaAlO2溶液与NaHCO3溶液混合
④FeCl3溶液与NaHS溶液混合
⑤用铁作阳极长时间电解足量Na2SO4溶液
| A.2组 | B.3组 | C.4组 | D.5组 |
不同固态物质分子1 mol,体积大小并不相同,主要原因是
| A.微粒大小不同 | B.微粒质量不同 |
| C.微粒间平均距离不同 | D.微粒间引力不同 |
下列实验操作中错误的是
| A.蒸发结晶操作时,当有大量晶体析出时停止加热,用余热蒸干 |
| B.蒸馏操作时,应使温度计水银球插入液态混合物中 |
| C.分液操作时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 |
| D.萃取操作时,萃取剂要和原溶剂互不相溶,且不能与溶质和溶剂反应 |
已知a克N2含有 b个分子,则阿伏加德罗常数的数值为:
A. |
B. |
C.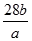 |
D.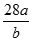 |
下列两种气体的分子数一定相等的是
| A.质量相等、密度不等的N2和CO | B.等体积、等密度的CO和NO |
| C.等温、等体积的O2和N2 | D.等压、等体积的N2和CO2 |
相等物质的量的CO2和CO相比较,下列有关叙述中正确的是
①它们所含的分子数目之比为1:1
②它们所含的O原子数目之比为1:2
③它们所含的原子总数目之比为2:3
④它们所含的C原子数目之比为1:1
| A.①④ | B.①③④ | C.②③ | D.①②④ |