为检查某石灰石样品中碳酸钙的纯度,取该样品24g放入烧杯中,再向烧杯中加入70g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中剩余固体物质共85.2g,
(1)反应生成CO2的质量为 g;
(2)石灰石样品中碳酸钙的质量分数。
【2015年浙江省杭州市】四氯化硅(SiCl4)是一种重要的化工原料,遇水会发生如下反应:SiCl4+3H2O=H2SiO3↓+4HCl某地曾发生将含有四氯化硅的废料倒入池塘造成污染的事件,事后环保人员在受污染的池塘中投放熟石灰〔Ca(OH)2〕作了有效处理。
(1)已经H2SiO3不跟Ca(OH)2反应,为了确定投入熟石灰的质量,要先测定废料倒入池塘后生成盐酸的质量。选用下列哪组数据能确定池塘中生成HCl的质量_______
A.倒入废料的总质量、废料中SiCl4的质量分数
B.池塘水的pH
C.池塘水中HCl的质量分数
(2)经测定池塘水中共有0.365吨盐酸,则需要加入多少吨熟石灰才能将其完全反应。
(列式计算,相对原子质量:H:1 O:16 Cl:35.5 Ca:40)
【2015年浙江省嘉兴市】用已知溶质质量分数的溶液可以测定未知溶液的溶质质量分数。实验室有一瓶标签模糊的稀盐酸,某同学为了测定其溶质质量分数,进行了如下实验:
①取一洁净的锥形瓶称量,然后往其中加入一定量的稀盐酸,并滴人几滴紫色石蕊试液(质量忽略不计),重新称量;
②往上述锥形瓶中逐滴加入溶质质量分数为16%的氢氧化钠溶液,边滴加边振荡,当观察到溶液由红色恰好变为紫色时,停止滴加,再次称量。数据如下表:
(1)若要配制500克16%的氢氧化钠溶液,需要氢氧化钠固体 克。
(2)本次实验中,实际消耗的氢氧化钠溶液质量为 克。
(3)请通过计算确定该瓶稀盐酸的溶质质量分数。
(4)另有同学做了同样的实验,却得到了不同的结果。于是用精密pH试纸测得反应后锥形瓶内溶液的pH为8.2,则他测出的盐酸溶质质量分数 (选填“偏大”或“偏小”),造成这一偏差的原因是 。
【2015年浙江省湖洲市】把萝卜块放入浓盐水中,萝卜块会皱缩。把姜焉的青菜放入清水中,青菜会变挺。这就都是生话常识,其中蕴含着科学道理,启迪我们去思考。
(1)观察人体口腔上皮细胞时,为什么要将口腔上皮细胞除抹在生理盐水(溶质质量分数为0.9%的氯化钠溶液)中?
(2)现有100克溶质质量分数为4.5%的氯化钠溶液,将它稀释成溶质质量分数为0.9%的生理盐水,需加水多少毫升?
【2015年福建省福州市】 (4分)某碳酸钠样品中混有少量氯化钠,根据图所示信息计算该样品中碳酸钠的质量分数。(计算结果精确到0.1%)
(反应的化学方程式:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl)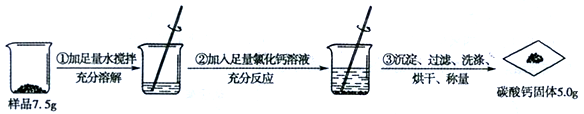
【2015年湖北省黄冈市】某石灰水中含有氢氧化钙2.96g,如果该石灰水吸收二氧化碳完全反应变成白色沉淀,则可以吸收二氧化碳的质量是多少?