已知NH4CuSO3与足量的1mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是( )
| A.NH4CuSO3中硫元素被氧化了 |
| B.刺激性气味的气体是二氧化硫和氨气的混合气体 |
| C.该反应中NH4CuSO3既作氧化剂又作还原剂 |
| D.该反应中硫酸既表现为酸性又表现强氧化性 |
下列粒子属等电子体的是()
| A.SO2和O3 | B.CH4和NH4+ |
| C.NH2—和H2O2 | D.HCl和H2O |
在理论上可用于设计原电池的化学反应是()
| A.2Al(s)+2NaOH(aq)+2H2O(1)=2NaAlO2(aq)+3H2(g);△H<O |
| B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H>0 |
| C.C3H8(g)+5O2(g)→4H2O (l)+3CO2(g);△H<0 |
D.FeCl3(aq)十3H2O(1)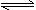 Fe(O Fe(O H)3(s)+3HCl(aq);△H>0 H)3(s)+3HCl(aq);△H>0 |
下列化学式中,能真实表示物质的分子组成的是()
| A.CuSO4 | B.CS2 | C.Ar | D.CsCl |
一种新型燃料电池,它是用两根金属做电极 插入KOH溶液中,然后向两极上分别通甲烷和氧气,其电池反应为:X极:CH4+10OH――8e-=CO32-+7H2O Y极:4H2O+2O2+8e-=8OH-。下列关于此燃料电池的有关说法中错误的是( )
插入KOH溶液中,然后向两极上分别通甲烷和氧气,其电池反应为:X极:CH4+10OH――8e-=CO32-+7H2O Y极:4H2O+2O2+8e-=8OH-。下列关于此燃料电池的有关说法中错误的是( )
| A.通过甲烷的电极(X)为电池的负极,通过氧气的电极(Y)为电池正极 |
| B.放电一段时间后,电解质溶液中KOH的物质的量改变 |
| C.在标准状况下,通过5.6L氧气,完全反应后有1.0mol的电子发生转移 |
| D.放电时,通过甲烷的一极附近的pH升高 |
下列有关化学键与晶体的说法中,不正确的是( )
| A.离子晶体的晶格能越大,离子晶体的熔点越高 |
| B.离子化合物中不一定只含有离子键 |
| C.成键原子的原子轨道重叠越多,共价键越牢固 |
| D.共价键的键能越大,分子晶体的熔、沸点越高 |