氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用相同的是( )
| A.2Na + 2H2O=2NaOH + H2↑ |
| B.2F2+2H2O=4HF+O2 |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
下列变化中,必须加入氧化剂才能发生的是()
| A.SO2→S | B.SO32—→SO2 | C.HCO3—→CO32— | D.Cl—→Cl2 |
下列反应的离子方程式书写正确的是
| A.AlCl3溶液中加入足量的氨水:Al3++ 3OH-══ Al(OH)3↓ |
| B.Cl2和H2O反应:Cl2+H2O===2H++Cl—+ClO— |
| C.盐酸与Na2SiO3溶液:SiO32—+2H+===H2SiO3↓ |
| D.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑ |
下列各图所示的实验操作,不能达到相应的实验目的的是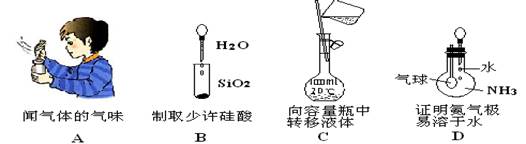
某无色透明的溶液中加入铝粉能放出氢气,此溶液中一定能大量共存的离子组是()。
| A.H+、Cu2+、Cl—、SO42— | B.HCO3—、NO3—、SO42—、Na+ |
| C.Cl—、SO42— 、K+、Na+ | D.Ca2+、SO42—、CO32—、Cl— |
下列关于SO2的叙述,正确的是A
| A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 |
| B.SO2是硫酸的酸酐 |
| C.大气中SO2的主要来源是汽车排出的尾气 |
| D.SO2具有漂白性,因而可以使石蕊试液褪色 |