下述实验设计能够达到目的的是( )。
| 选项 |
实验目的 |
实验设计 |
| A |
除去CO2中少量的SO2 |
将混合气体通过饱和Na2CO3溶液 |
| B |
证明H2CO3酸性比H2SiO3强 |
将CO2通入Na2SiO3溶液中 |
| C |
检验溶液中是否含有Fe2+ |
向溶液中滴入氯水后,再滴加KSCN溶液 |
| D |
除去Cu粉中混有的CuO |
向混合物中滴加适量稀硝酸 |
下列说法正确的是
| A.脂肪烃、芳香烃和卤代烃都属于烃 |
| B.天然气、沼气和水煤气都属于可再生的清洁能源 |
| C.工业上分别用热还原法、加热法和电解法冶炼镁、铝和铜 |
| D.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
化学与生活、社会密切相关。下列说法不正确的是
| A.用浓H2SO4刻蚀工艺玻璃上的纹饰 |
| B.用含Al(OH)3的药物治疗胃酸过多 |
| C.用Ca(OH)2处理酸性废水 |
| D.用加入Na2S的方法除去废水中的Hg2+ |
材料与化学密切相关。下列物质与材料对应关系不正确的是
| A.晶体硅——光导纤维 | B.氧化铝——耐火材料 |
| C.铁碳合金——碳素钢 | D.硅酸盐——普通玻璃 |
将AgCl分别加入盛有:①5 mL水;② 6 mL 0.5 mol/L NaCl溶液;
③10 mL 0.2 mol/L CaCl2溶液;④50 mL 0.1 mol/L 盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是
| A.④③②① | B.②③④① | C.①④③② | D.①③②④ |
在下列溶液中,一定能大量共存的一组离子是
A.溶液的pH=13:ClO-、HCO 、Na+、Mg2+ 、Na+、Mg2+ |
B.溶液中含有大量NO :NH4+、I-、SO :NH4+、I-、SO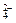 、H+ 、H+ |
C.溶液中c(HCO )=0.1 mol/L:Na+、K+、CO )=0.1 mol/L:Na+、K+、CO 、Br- 、Br- |
| D.溶液中由水电离出的c(H+)=1×10-13mol/L:Na+、H+、Cl-、Br- |