常温下,往 溶液中滴加少量
溶液中滴加少量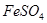 溶液,可发生如下两个反应:
溶液,可发生如下两个反应: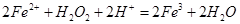 ,
,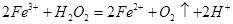 下列说法正确的是
下列说法正确的是
A.在 分解过程中, 分解过程中,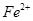 和 和 的总量保持不变 的总量保持不变 |
B. 的氧化性比 的氧化性比 强,其还原性比 强,其还原性比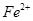 弱 弱 |
C.在 分解过程中,溶液的 分解过程中,溶液的 逐渐下降 逐渐下降 |
D. 生产过程中加入少量 生产过程中加入少量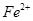 可以提高产率 可以提高产率 |
能正确表示下列反应的离子方程式是()
| A.氯气与水的反应: Cl2+H2O=2H++Cl-+ClO- |
| B.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| C.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D.硫酸氢钠与氢氧化钠溶液反应:H++OH-= H2O |
常温时向水中加入少量固体MgCl2,水的电离被______;与纯水相比,所得溶液中KW 。()
| A.促进不变 | B.促进减小 |
| C.抑制不变 | D.抑制变小 |
中学化学中很多规律都有其使用范围,下列根据有关“规律”推出的结论合理的是()
| A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 |
| D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
长式周期表共有18个纵行,从左到右排为1-18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是()
| A.第9列元素中有非金属元素 |
| B.只有第二列的元素原子最外层电子排布为ns2 |
| C.第四周期第8列元素是铁元素 |
| D.第15列元素原子的最外层电子排布为ns2np5 |
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2, 因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是()
O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是()
A.CO与HbO2反应的平衡常数K=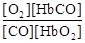 |
| B.人体吸入的CO越多,与血红蛋白结合的O2越少 |
| C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损 |
| D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动 |