下列说法正确的是
| A.HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高 |
| B.熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C.NCl3分子中所有的原子均为8电子稳定结构 |
| D.NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
用硫酸铁电化浸出黄铜矿精矿工艺中,精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+ Cu2++5Fe2++2S。下列说法正确的是
Cu2++5Fe2++2S。下列说法正确的是
| A.反应中硫元素被氧化,所有铁元素均被还原 |
| B.还原剂是Fe3+,氧化剂是S2— |
| C.氧化产物是S,还原产物是Cu2+和Fe2+ |
| D.当转移1mol电子时,46 g CuFeS2参加反应 |
已知在溶液中,还原性:HSO3—> I—,氧化性:IO3—> I2 > SO42—。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则下列说法错误的是
I—,氧化性:IO3—> I2 > SO42—。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则下列说法错误的是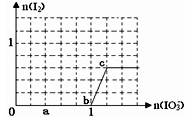
| A.a点时NaHSO3过量 |
| B.b点时的还原产物为I— |
C.b点到c点,KIO 3与NaHSO3反应生成I2 3与NaHSO3反应生成I2 |
| D.加入的KIO3为0.4 mol 或1.12 mol时,I—均为0.4 mol |
下列离子方程式与所述事实相符且正确的是
A.用H2O2酸性溶液,将海带灰中的I-转变为I2:H2O2+2I- I2+2OH- I2+2OH- |
B.高锰酸钾与足量浓盐酸反应制氯气:2MnO4-+16H++10Cl- 2Mn2++5Cl2↑+8H2O 2Mn2++5Cl2↑+8H2O |
C.AlCl3溶液中滴加过量氨水:Al3++4NH3·H2O AlO2—+4NH4++2H2O AlO2—+4NH4++2H2O |
D.漂白粉溶液中,通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O CaCO3↓+2HClO CaCO3↓+2HClO |
CaC2是离子型金属碳化物,容易发生水解反应,生成乙炔和氢氧化钙。现有ZnC2、Al4C3、Mg2C3、Li2C2等,同属于离子型金属碳化物,也很容易发生水解反应。请从CaC2跟H2O反应生成C2H2的反应过程进行思考,从中得到必要的启示,判断下列物质的水解产物是C3H4的是
| A.ZnC2 | B.Al4C3 | C.Mg2C3 | D.Li2C2 |
向等量的NaOH溶液中分别通入CO2气体。因CO2的通入量不同,得到组分不同的溶液M。若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)关系如下,(注:①假设CO2全部逸出;②C图中oa=ab)。其中M中只有1种溶质的是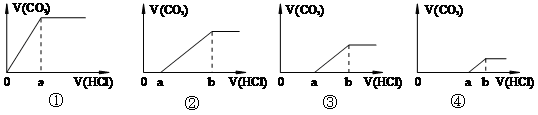
| A.只有① | B.只有③ | C.②④ | D. ①③ ①③ |