电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72—+6Fe2+ +14H+ 2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是
2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是
| A.电解过程中溶液pH不会变化 |
B.阳极反应为Fe-2e- Fe2+ Fe2+ |
| C.过程中有Fe(OH)3沉淀生成 |
| D.电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原 |
A(盐)和B(酸)反应,可放出有气味的气体C,C跟KOH反应又得到A(盐),C氧化的最终产物为W气,W气溶于水又得到B(酸)是( )
| A.K2S和稀H2SO4 | B.K2SO3和盐酸 |
| C.K2S和盐酸 | D.K2SO3和稀H2SO4 |
下列溶液露置于空气中,开始一段时间其pH变小的是(不考虑溶质挥发)( )
①H2O2②H2SO3③Na2S④Ca(OH)2⑤氯水⑥Na2SO3
| A.①②④ | B.②⑤⑥ |
| C.①②④⑤ | D.②④⑤⑥ |
下列离子方程式正确的是( )
A.二氧化硫通入足量KOH溶液中SO2+2OH-  +H2O +H2O |
B.往澄清石灰水中通入足量二氧化硫SO2+Ca2++2OH- CaSO3↓+H2O CaSO3↓+H2O |
C.往二氧化硫的水溶液中滴加少量NaOH溶液H2SO3+OH-  +H2O +H2O |
D.亚硫酸中滴加双氧水生成硫酸H2SO3+2H++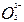  2H++ 2H++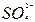 +2H2O +2H2O |
在氯化钡溶液通入SO2,溶液仍澄清,若将氯化钡溶液分装两支试管,一支加硝酸,另一支加NaOH溶液,然后再通入SO2,结果两试管中都有白色沉淀生成,由此得出下列结论合理的是( )
| A.氯化钡有两性 |
| B.两支试管中的白色沉淀都是BaSO4 |
| C.SO2具有还原性和酸性 |
D.加碱后溶液中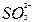 浓度增大 浓度增大 |
为了除去SO2中的SO3,以制得纯的SO2,下列试剂最好选用( )
| A.石灰水 | B.饱和NaHSO3 |
| C.浓H2SO4(98.3%) | D.饱和Na2SO3溶液 |