下列对于溶液中的问题叙述正确的是( )
| A.向冰醋酸中加水至配成醋酸稀溶液的过程H+的浓度逐渐减小 |
| B.在稀溶液中:H+(aq) + OH-(aq) = H2O(l); △H=-57.3kJ/mol,则含1 mol HClO的稀溶液和含1 mol KOH的稀溶液完全反应放出的热量等于57.3 kJ |
| C.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等 |
| D.常温下,将稀NaOH溶液与CH3COOH溶液混合,可能出现pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况 |
在a、b两个相同的容器中,分别加入相同量的A和B,发生可逆反应:A(g)+3B(g)  2C(g)(正反应为放热反应),两容器中C的体积分数与时间的关系如图所示,则a、b两线不同的可能原因是
2C(g)(正反应为放热反应),两容器中C的体积分数与时间的关系如图所示,则a、b两线不同的可能原因是
| A.a的温度高于b |
| B.a使用了催化剂,而b未用 |
| C.a的压强大于b |
| D.a的温度低于b |
可逆反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),若反应速率分别用
4NO(g)+6H2O(g),若反应速率分别用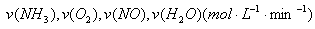 表示,则关系正确的是
表示,则关系正确的是
已知空气—锌电池的电极反应为:锌片:Zn + 2OH――2e-=" ZnO" + H2O石墨:1/2O2+H2O + 2e- = 2OH-据此判断,锌片是:
| A.负极,并被氧化 | B.负极,并被还原 |
| C.正极,并被氧化 | D.正极,并被还原 |
常温下,1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于
| A.9.0 | B.9.5 | C.10.5 | D.11.5 |
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
| A.1mol/L氢氰酸溶液的pH约为3 |
| B.HCN易溶于水 |
| C.10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应 |
| D.HCN溶液的导电性比强酸溶液的弱 |