通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
| 键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的反应热△H为( )
Si(s)+4HCl(g),该反应的反应热△H为( )
A.+412 kJ·mol-1 B.-412 kJ·mol-1
C.+236 kJ·mol-1 D.-236 kJ·mol-1
下列氧化物中,能与水反应生成酸的是
| A.SiO2 | B.NO | C.SO3 | D.Al2O3 |
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是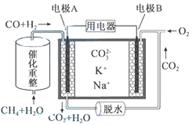
A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol电子 3H2+CO,每消耗1molCH4转移12mol电子 |
| B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
| C.电池工作时,CO32-向电极B移动 |
| D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
向分别含SO32-、Fe2+、Br-、I-各0.1mol的溶液中,通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系图正确的是: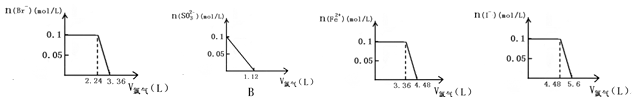
A. B. C.D.
右图为元素周期表截取的短周期的一部分,即 。四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是
。四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是
| A.原子半径:W>Z>Y>X |
| B.气态氢化物的稳定性:Z>W>X>Y |
| C.W的最高正化合价与负化合价的绝对值可能相等 |
| D.Z的最高价氧化物的水化物可能为强碱 |
甲乙丙是三种不含相同离子的可溶性电解质。他们所含的离子如表所示。取等质量的三种化合物配制相同体积的溶液,其物质的量浓度:c(甲)<c(乙)<c(丙),下列说法正确的是
| 阳离子 |
Na+ NH4+ Fe3+ |
| 阴离子 |
OH- Cl- SO42- |
A、甲中一定含有Na+ B、乙中一定含有NH4+
C、丙中一定含有 Fe3+ D、丙中一定含有SO42-