为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是: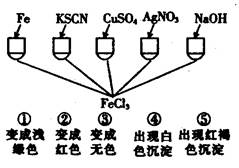
| A.只有④ |
| B.只有③ |
| C.③和④均错 |
| D.全部错误 |
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生。下列有关说法正确的是
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,正反应和逆反应的速率都为零 |
| D.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
已知在25oC,101kPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
A.C8H18(l)+ O2(g)= 8CO2(g)+9H2O(g);ΔH = -48.40kJ/mol O2(g)= 8CO2(g)+9H2O(g);ΔH = -48.40kJ/mol |
B.C8H18(l)+ O2(g)= 8CO2(g)+9H2O(l);ΔH = -5518kJ/mol O2(g)= 8CO2(g)+9H2O(l);ΔH = -5518kJ/mol |
C.C8H18(l)+ O2(g)= 8CO2(g)+9H2O(l);ΔH = +5518kJ/mol O2(g)= 8CO2(g)+9H2O(l);ΔH = +5518kJ/mol |
D.C8H18(l)+ O2(g)= 8CO2(g)+9H2O(l);ΔH = -48.40kJ/mol O2(g)= 8CO2(g)+9H2O(l);ΔH = -48.40kJ/mol |
银锌电池广泛用作各种电子仪器的电源,它的放电过程可以表示为Ag2O+ Zn+H2O = 2Ag+Zn(OH)2. 电池放电时,负极发生反应的物质是
| A.Ag | B.Zn | C.Ag2O | D.Zn(OH)2 |
常温下,将NaHY晶体加入水中溶解,得到0.1mol/L NaHY溶液,下列叙述正确的是
| A.若NaHY的水溶液显碱性,该溶液中粒子浓度关系为:c(Na+)>c(OH-)> c(H+)> c(HY-) |
| B.若溶液中粒子浓度关系为c(H+)+c(H2Y)= c(OH-)+ c(Y2-),则NaHY的水溶液一定显碱性 |
| C.将NaHY晶体加入水中一定能促进水的电离 |
| D.若NaHY溶液的pH=4,该溶液中粒子浓度关系为:c(Na+)>c(HY-)> c(H+)> c(Y2-)>c(H2Y) |
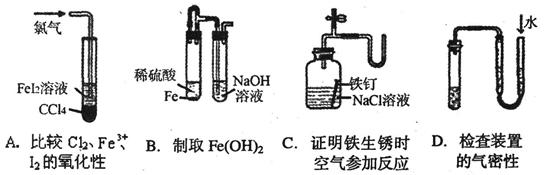
下列装置或操作不能达到实验目的的是