下列有关离子方程式书写错误的是:
| A.将标准状况下1.12 L氯气通入10 mL 1 mol / L的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
| B.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++ HCO3- +OH-=CaCO3↓+H2O |
| C.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++ SO42- + NH4+=BaSO4↓+ NH3·H2O +H2O |
| D.向NaHSO3溶液中滴入适量NaClO溶液:HSO3–+ ClO–=SO42–+ H+ + Cl– |
在陆地生态系统研究中,2H、13C、l5N、18O、34S等常用作环境分析指示物。下列说法正确的是
A.34S原子核内中子数为16B.16O2比18O2沸点更低
C.2H+的酸性比1H+的酸性更强D.13C和15N原子核内的质子数相差2
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 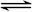 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。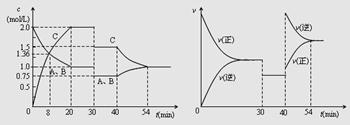
下列说法中正确是
| A.30min时降低温度,40min时升高温度 |
| B.8min前A的平均反应速率为0.08mol/(L·min) |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D.20min~40min间该反应的平衡右移。 |
在密闭容器中发生如下反应:aX(g)+bY(g) cZ(g)+dW(g),反应达平衡后保持温度不变,将气体体积压缩到原来的1/2,当再次达平衡时,W的浓度为原平衡时的1.8倍.下列叙述中不正确的是
cZ(g)+dW(g),反应达平衡后保持温度不变,将气体体积压缩到原来的1/2,当再次达平衡时,W的浓度为原平衡时的1.8倍.下列叙述中不正确的是
| A.平衡向逆反应方向移动 | B.a+b<c+d |
| C.Z的体积分数增加 | D.X的转化率下降 |
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示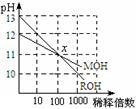
下列叙述中错误的是
| A.ROH是一种强碱 |
| B.稀释前,c(ROH) =10 c(MOH) |
| C.在x点,ROH完全电离 |
| D.在x点,c(M+) = c(R+) |
下表是五种银盐的溶度积常数(25℃):
| 化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
| 溶度积 |
1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.51×10-16 |
下列说法错误的是
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动