氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O – 2e- → SO42- + 4H+; (2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2 + 2e- → 2Cl-。在(1)和(2)反应中均会生成产物X,则X的化学式为
| A.NaClO | B.NaClO4 | C.HClO | D.ClO2 |
下列溶液中离子浓度关系的表示正确的是 ( )
| A.NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO)+c(HCO) |
| B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后的溶液中: c(OH-)>c(H+)+c(CH3COO-) |
| C.0.1 mol·L-1的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH)>c(OH-) |
| D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中: |
2c(Na+)=c(CH3COOH)+c(CH3COO-)
电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是()
| A.电解时以硫酸铜溶液作电解液,精铜作阳极 |
| B.粗铜与电源负极相连,发生氧化反应 |
| C.阴极上发生的反应是Cu2+ + 2e-=Cu |
| D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥 |
关于铅蓄电池的说法正确的是
| A.在放电时,正极发生的反应是 Pb(s) +SO42—(aq) -2e—= PbSO4(s) |
| B.在放电时,该电池的负极材料是铅板 |
| C.在充电时,电池中硫酸的浓度不断变小 |
| D.在充电时,阳极发生的反应是 PbSO4(s)+2e—=" Pb(s)+" SO42—(aq) |
可用电解法提取氯化铜废液中的铜,下列有关该实验的说法正确的是
| A.用铜片连接电源的正极,另一电极用铂片 |
| B.用碳棒连接电源的正极,另一电极用铜片 |
| C.用氢氧化钠溶液吸收阴极产物 |
| D.用带火星的木条检验阳极产物 |
β—月桂烯的结构如图所示: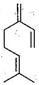 ,一分子该物质与两分子溴发生加成反应的产物(不考虑顺反异构)理论上最多有
,一分子该物质与两分子溴发生加成反应的产物(不考虑顺反异构)理论上最多有
| A.2种 | B.3种 | C.4种 | D.6种 |