900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: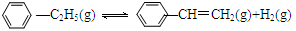 ΔH=a kJ·mol—1。
ΔH=a kJ·mol—1。
经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| 时间/min |
0 |
10 |
20 |
30 |
40 |
| n(乙苯)/mol |
0.40 |
0.30 |
0.24 |
n2 |
n3 |
| n(苯乙烯)/mol |
0.00 |
0.10 |
n1 |
0.20 |
0.20 |
下列说法正确的是
A.反应在前20 min的平均速率为v(H2)=0.008mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol·L-1,则a<0
C.保持其他条件不变,再向容器中充入0.40 mol乙苯和0.40molH2,平衡不移动
D.达平衡状态的标志是气体密度不再变化
家发改委、中宣部等十七部委在人民大会堂举行“节能减排全民行动”启动仪式,要求在全国范围内形成全民节能减排氛围。下列有关做法不符合这一要求的是
| A.将煤液化、气化,提高燃料的燃烧效率 |
| B.在汽车上安装汽车尾气催化转化装置,使之发生如下反应: 2CO+2NO2CO2+N2 |
C.在大力推广乙醇汽油的同时,研究 开发太阳能汽车和氢燃料电池汽车 开发太阳能汽车和氢燃料电池汽车 |
| D.在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电 |
有四种钠的化合物W、X、Y、Z,根据下列反应式判断W、X、Y、Z的化学式。
① W →X + CO2↑ +H2O② Z + CO2→ X + 02
③  Z+ H2O → Y + 02↑④ X + Ca(OH)2→ Y + CaCO3↓
Z+ H2O → Y + 02↑④ X + Ca(OH)2→ Y + CaCO3↓
W;X;Y;Z。
A、 B、C、D四种短周期元素,它们的核电荷数依次增大;A元素原子核外只有一个电子;C元素的焰色反应呈黄色;B元素原子L层电子数是K层电子数的3倍;D原子核中的质子数比C多6个。
B、C、D四种短周期元素,它们的核电荷数依次增大;A元素原子核外只有一个电子;C元素的焰色反应呈黄色;B元素原子L层电子数是K层电子数的3倍;D原子核中的质子数比C多6个。
回答:
⑴.A是,B是。
⑵.C元素最高价氧化物对应水化物的化学式为。
⑶C和D形成的化合物的化学键类型为。(填“离子键”或“共价键”)
⑷.D元素在周期表中的位置是第周期第族。
有A、B、C三种物质,它们的分子中都含有14个电子,其中A是由双原子分子组成的单质,B仅由碳、氢两种元素组成,C的分子由碳、氧两种原子构成。
根据以上叙述填写下列空白:
(1)A的电子式为;(2)B的结构式为;
(3)C的分子式为;
(4)A与H2在一定条件下可化合生成一种化合物,该化合物的名称是。
氢氧化铝既可以与酸反应又可以与碱反应,是典型的两性氢氧化物。氢氧化铝和盐酸反应的化学方程式为;和NaOH溶液反应的化学方程式为。