液晶高分子材料应用广泛。新型液晶基元------化合物Ⅳ的合成线路如下:
(1)化合物Ⅰ的分子式为__________ ,1mol化合物Ⅰ完全燃烧消耗_____molO2。
(2)CH2=CH-CH2Br与NaOH水溶液反应的化学方程式为_____ ____(注明条件)。
(3).出符合下列条件的化合物Ⅰ的同分异构体的结构简式 。
I.苯环上有3个取代基; II.苯环上一溴代物只有2种. III.能发生银镜反应
(4)下列关于化合物Ⅱ的说法正确的是_______(填字母)。
| A.属于烯烃 | B.能与FeCl3溶液反应呈紫色 |
| C.一定条件下能发生加聚反应 | D.最多能与4molH2发生加成反应 |
(5)反应③的反应类型是____________。在一定条件下,化合物 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是______________。
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是______________。
按要求填空:
(1)常温下将0.1molCO2气体通入1L 0.2mol·L-1NaOH溶液中,测得混合溶液的pH=12,则混合溶液pH=12的原因是(用离子方程式表示),混合溶液中由水电离出的c(H+) 0.2mol·L-1NaOH溶液中由水电离出的c(H+)。(填“>”或“<”或“=”)
(2)常温下若将0.2mol·L-1MOH溶液与0.1mol·L-1HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”或“<”或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH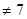 ,则HR的电离方程式为。
,则HR的电离方程式为。
(4)常温下将0.1mol/L的HCN溶液与0.1mol/L的NaCN溶液等体积混合,已知溶液中c(Na+)>c(CN﹣),则该混合溶液中的pH____7(填“>”或“<”或“=”),c(HCN)+c(CN﹣)=______mol/L。
(5)常温下,0.1mol/L的某一元酸HA在水中的电离度为0.1%(电离度是指溶液中已电离的溶质分子数占原有溶质分子总数的百分率),则该溶液的pH=,HA的电离平衡常数K=。
(6)水的电离平衡如右图所示。若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为;将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为。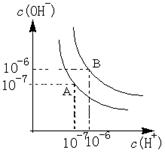
碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲硅烷(SiH4)的结构与甲烷相似。SiH4分子为________分子(填极性或非极性),SiH4分子中H原子的1s轨道与Si原子的sp3轨道重叠形成Si—H_____ (填“σ键”或“π键”);甲硅烷能与硝酸银发生如下反应:SiH4 + 8AgNO3 + 2H2O=8Ag↓ + SiO2↓ + 8HNO3,该反应中氢元素被氧化,则SiH4充当_______剂(填氧化或还原),由此可判断电负性:SiH(填“>”、“<”或“=”)。
(2)下图中,能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的是___填标号)。 (3)①一种含Cr的催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子的电子排布式为。
(3)①一种含Cr的催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子的电子排布式为。
②石墨晶体具有层状结构,质软、熔点高、能导电,其导电原理同金属晶体,则其导电的粒子是(填“阳离子”、“阴离子”或“自由电子”)。
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l)  CH3COOC2H5(l)+H2O(l)ΔH=-8.62kJ·mol-1
CH3COOC2H5(l)+H2O(l)ΔH=-8.62kJ·mol-1
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。
(1)该研究小组的实验目的是__________________。
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率___________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是______(写出两条)。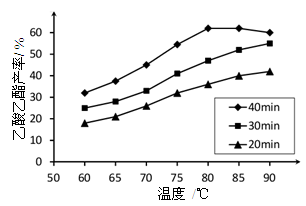
(4)某温度下,将0.10 mol CH3COOH溶于水配成1 L溶液。
①实验测得已电离的醋酸分子占原有醋酸分子总数的1.3%,则该温度下CH3COOH的电离平衡常数K=____________________。(水的电离忽略不计,醋酸电离对醋酸分子浓度的影响忽略不计)
②向该溶液中再加入__________mol CH3COONa可使溶液的pH约为4。(溶液体积变化忽略不计)
I:已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:T℃时物质的浓度(mol•L-1)变化
| 时间/ min |
CO |
H2O(g) |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100 |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
C1 |
| 6 |
0.096 |
0.266 |
0.104 |
C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 ,T℃时该化学反应的平衡常数是 。在该温度下,若向一容积固定的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和2.0mol H2,则反应向 进行。(填“正反应方向”或“逆反应方向”)。
(2)已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol•L-1,则CO在此条件下的转化率为 ,如果保持体积不变向该密闭容器中再充入1 mol氩气,平衡时CO的转化率(填“变大”“不变”“变小”)。
(3)397℃时该反应的平衡常数为12,请判断该反应的△H 0(填“<”、“>”或“=”)。
Ⅱ:工业上可用CO和H2在一定条件下合成甲醇,反应为:
CO(g)+2H2(g) CH3OH(g)ΔH=Q kJ•mol-1
CH3OH(g)ΔH=Q kJ•mol-1
现在容积均为2L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
(1)该反应的Q0(选填“<”、“>”或“=”,下同),K1K2。
(2)300℃时,该反应的平衡常数为。
(3)将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有:____________
(至少答2种) 。
根据下列化合物:①NaOH,②H2SO4,③CH3COOH, ④NaCl, ⑤CH3COONa, ⑥NH4Cl,⑦CH3COONH4,⑧NH4HSO4, ⑨NH3•H2O,请回答下列问题:
(1)NH4Cl溶液中离子浓度大小顺序为;
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=;
在pH=3的CH3COOH 溶液中,水电离出来的c(H+)=;
(3)已知水存在如下平衡:H2O+ H2O H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是。
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是。
| A.向水中加入NaHSO4固体 | B.向水中加NaHCO3固体 |
| C.加热至100℃[其中c(H+)=1×10-6 mol•L-1] | D.向水中加入NH4Cl固体 |
(4)若浓度均为0.1 mol·L-1、等体积的NaOH和NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则 mn (填“<”、“>”或“=”)。
(5)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液,按pH由大到小的顺序为(填序号)___ ___。
(6) 物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH 浓度由大到小的顺序是(填序号)。
浓度由大到小的顺序是(填序号)。
(7)已知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=____。