(I)下图是工业生产硝酸铵的流程。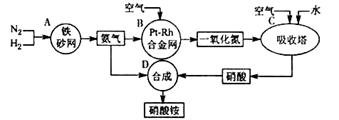
(1)吸收塔C中通入空气的目的是 。A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) +6H2O(g) △H =-1266.8kJ/mol
N2(g) + O2(g) = 2NO(g) △H =" +180.5" kJ/mol
写出氨高温催化氧化的热化学方程式:
(II)某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(3)该反应的离子方程式为___________________________________________________。
(4)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
A.反应放热导致温度升高 B.压强增大
C.生成物有催化作用 D.反应物接触面积增大
(5)初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
35 |
50 |
60 |
70 |
80 |
| 温度/℃ |
25 |
26 |
26 |
26 |
26 |
26 |
26.5 |
27 |
27 |
27 |
27 |
结合实验目的和表中数据,你得出的结论是__________________________________。
(6)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请完成以下实验设计表并将实验目的补充完整:
| 实验 编号 |
铜片 质量/g |
0.1mol·L-1的 硝酸体积/mL |
硝酸铜 晶体/g |
亚硝酸钠 晶体/g |
实验目的 |
| ① |
5 |
20 |
_______ |
_______ |
实验①和②探究_________的影响;实验①和③探究亚硝酸根的影响。 |
| ② |
5 |
20 |
0.5 |
0 |
|
| ③ |
5 |
20 |
0 |
0.5 |
(1)FeCl3的水溶液呈 (“酸”、“中”、“碱”)性,常温时的pH7(填“>”、“=”、“<”),原因是(用离子方程式表示):。
(2)实验室在配制 FeCl3的溶液时,常将FeCl3固体先溶于中,然后再用蒸馏水稀释到所需的浓度。
(3)把FeCl3溶液蒸干,灼烧,最后得到的主要产物是。
(4)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒中盛碳酸氢钠溶液,其化学反应的原理是(用离子方程式解释)。碳酸氢钠溶液中的电荷守恒式为 ,溶液中离子浓度由大到小的顺序为。
有A、B、C、D、E、F六种化合物,它们之间的反应关系如下所示:
①A+B→C+E②C+NaOH→蓝色沉淀 D+F③D A+E
A+E
④F+Ba(NO3)2→白色沉淀+NaNO3
回答下列问题(1)写出它们的化学式:
A _____ B____ C____ D ______ E _______ F_______。
(2)写出①④反应的离子方程式
①___________________________________
④___________________________________
在0.5 mol/L的NaHSO3溶液中滴入石蕊,溶液变红。试回答下列问题:
(1)该溶液中HSO3-的电离程度______(填“大于”、“小于”或“等于”)HSO3-的水解程度。
(2)溶液中Na+、HSO3-、H+、OH-、SO32-等离子的浓度由大到小的顺序为____________。
(3)在Na2SO3溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是__________________。
(1)将一定量氨气通入盐酸中,溶液pH恰好为7(25 ℃),则氨的物质的量_____(填“<”、“=”或“>”)盐酸中HCl的物质的量;溶液中c(NH4+)_____c(Cl-)。
(2)向同体积同物质的量浓度的盐酸和氯化铵溶液中加入等质量的镁粉,镁完全反应后,盐酸放出气体的体积_____氯化铵溶液放出气体的体积。
(3)向盐酸中通入NH3至恰好完全反应时,所得溶液由H2O电离出来的c(H+)比纯水电离出来的c(H+)_____(填“大”、“小”或“相等”)。
常温下,有0.1 mol/L的盐酸和0.1 mol/L的醋酸溶液,回答下列问题:
(1)比较两溶液的pH,盐酸______(填“<”、“=”或“>”)醋酸,
(2)写出醋酸电离的方程式__________。
(3)向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为______。