某无色溶液中含有NH4+、K+、Al3+、SO42ˉ四种离子,进行如下实验:
(1)取10 mL该溶液于试管中并滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03 mol白色沉淀;
(2)取10 mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体(必要时可加热),最后沉淀完全溶解。并且随NaOH溶液的加入,沉淀和气体的变化关系如下图所示。 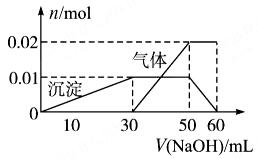
下列说法不符合事实的是( )
| A.根据图所示数据计算实验中使用的NaOH溶液的物质的量浓度为1mol/L |
| B.根据信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为1mol/L |
| C.另取一定量该溶液滴加一定量的Ba(OH)2溶液,能使Al3+和SO42ˉ同时完全沉淀 |
| D.NH4+、K+、Al3+、SO42ˉ四种离子的物质的量之比为:2:1:1:3 |
用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察到火焰呈黄色,下列各判断正确的是
| A.只含有Na+ | B.一定含有Na+,可能含有K+ |
| C.既含有Na+,又含有K+ | D.可能含有Na+,可能还会有K+ |
2.3g纯净物金属钠在干燥空气中被氧化后得到3.5g固体,由此可判断其氧化产物是
| A.只有Na2O | B.只有Na2O2 |
| C.Na2O和Na2O2 | D.无法确定 |
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下以性质错误的是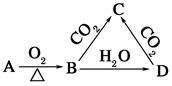
| A.溶液显碱性 |
| B.与澄清石灰水反应产生白色沉淀 |
| C.与足量盐酸反应产生气体 |
| D.受热易分解 |
纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体,下列区分这两种物质的方法中正确的是
| A.分别用砂锅加热两种样品,全部分解挥发没有残留物的是小苏打 |
| B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色发生明显变化的是小苏打 |
| C.用两只小玻璃杯,分别加入少量的两种样品,再加入等量的食醋,产生气泡快的是小苏打 |
| D.将样品配成溶液,分别加入澄清石灰水,无白色沉淀生成的是小苏打 |
用铝箔包裹0.1mol金属钠,用针刺出一些小孔,放入水中,完全反应后,产生的气体的体积为(标准状况)
| A.小于1.12L | B.1.12L |
| C.在1.12L和4.48L之间 | D.大于4.48L |