一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下:
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式________ ____________。
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是 。
(4)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是___ ___(填序号)。
| A.c(Na+) = 2c(CO32-) |
| B.c(Na+) > c(HCO3-) > c(CO32-) |
| C.c(OH-) > c(HCO3-) > c(H+) |
| D.c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) |
(5)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是______。
下表是生活生产中常见的物质,表中列出了它们的一种主要成分:
请你对表中①~⑦的主要成分进行分类(填编号)
属于盐的是_________,属于电解质的是________,属于非电解质的是_______。
 当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是。
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是。
⑷在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是。
28.(9分)下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D中选择
A. M>NB. M<NC. M="N" D. 无法比较
⑴相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数和2 L 0.5mol·L-1NH4Cl溶液中NH4+的个数:;
⑵相同温度下,pH值为12的烧碱溶液中水的电离度和pH值为12的CH3COONa溶液中水的电离度:;
⑶两份室温时的饱和石灰水,一份升温到50℃;另一份加入少量CaO,恢复至室温,两溶液中的c(Ca2+):;
⑷常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-):;
⑸将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值:;
⑹常温下0.1mol/L的CH3COOH与0.1mol/LCH3COONa等体积混合后溶液中c(Na+)和c(CH3COO-):;
⑺同 温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+的水解百分率:;
温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+的水解百分率:;
⑻室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7, 原酸溶液和原碱溶液的物质的量浓度:;
原酸溶液和原碱溶液的物质的量浓度:;
⑼PH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同,则M和N的关系是:。
(8分)废旧印刷电路板经粉碎分离能得到非金属粉末和金属粉末,回收利用可实现资源再生,减少污染。
⑴下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是(填字母)。
| A.热裂解形成燃油 | B.露天焚烧 | C.作为有机复合建筑材料的原料 | D.直接填埋 |
(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1T2(填“>”、“<”或“=”);A、C两点的速率vA vC(
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1T2(填“>”、“<”或“=”);A、C两点的速率vA vC( 同上)。
同上)。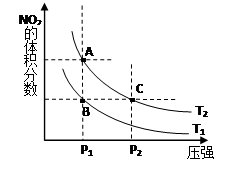
(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为;
②该反应的平衡常数K的值为;
③若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是mol/L。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为;(结果保留小数点后一位)
固定和利用CO2能 有效地利用资源,并减少空气中的温室气体。CO2与化合物Ⅰ反应生成化合物Ⅱ,与化合物III反应生成化合物Ⅳ,如反应①和②所示(其他试剂、产物及反应条件均省略)。
有效地利用资源,并减少空气中的温室气体。CO2与化合物Ⅰ反应生成化合物Ⅱ,与化合物III反应生成化合物Ⅳ,如反应①和②所示(其他试剂、产物及反应条件均省略)。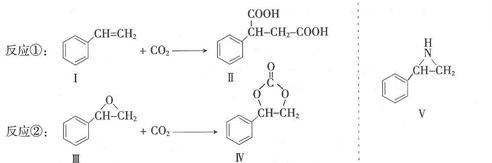
⑴化合物Ⅰ的分子式为 ,1 mol该物质完全燃烧需消耗 mol O2。
⑵由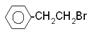 通过消去反应制备Ⅰ的化学方程式为 (注明反应条件)。
通过消去反应制备Ⅰ的化学方程式为 (注明反应条件)。
⑶Ⅱ与过量C2H5OH在酸催化下发生酯化反应,生成的有机物的结构简式为 .
⑷在一定条件下,化合物Ⅴ能与CO2发生类似反应②的反应,生成两种化合物(互为同分异构体),请写出其中任意一种化合物的结构简式: 。
⑸与CO2类似,CO也能被固定和利用,在一定条件下,CO、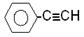 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应。下列关于Ⅵ和Ⅶ的说法正确的有 (双选,填字母).
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应。下列关于Ⅵ和Ⅶ的说法正确的有 (双选,填字母).
A都属于芳 香烃衍生物 B.都能使溴的四氯化碳溶液褪色
香烃衍生物 B.都能使溴的四氯化碳溶液褪色
C.都能与Na反应放出H2 D.1mol Ⅵ或Ⅶ最多能与4 mol H2发生加成反应