水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)写出与H2O分子互为等电子体的微粒 (填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是 ;
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是
(请用相应的编号字母填写);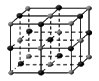
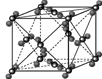

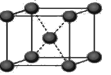
A B C D E
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是 kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g) ===CH4(g)+HC CH(g)+H2(g)△H1="156.6" kJ/mol
CH(g)+H2(g)△H1="156.6" kJ/mol
CH3CH CH2(g) ="==" CH4(g)+HC
CH2(g) ="==" CH4(g)+HC CH(g )△H2
CH(g )△H2 ="32.4" kJ/mol
="32.4" kJ/mol
则 相同条件下,反应C3H
相同条件下,反应C3H 8(g) ===CH3CH
8(g) ===CH3CH CH2(g)+H2(g)的△H=kJ/mol。
CH2(g)+H2(g)的△H=kJ/mol。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池总反应方程式为;放电时CO32-移向电池的(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=。(已知10-5.6
HCO3-+H+的平衡常数K1=。(已知10-5.6 0=2.5×10-6)
0=2.5×10-6)
(4)常温下,0.1 mol/L NaHCO3溶液的pH大于8,则溶液中c(H2CO3)c(CO32-)(填“>”、“=”或“<”),原因是
NaHCO3溶液的pH大于8,则溶液中c(H2CO3)c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
(用离子方程式和必要的文字说明)。
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=。已知: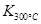 >
> ,则该反应是热反应。
,则该反应是热反应。
(2)右图中表示NO2的变化的曲线是。用O2表示从0~2 s内该反应的平均速率v=。
(3)能说明该反应已达到平衡 状态的是
状态的是 。
。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动是。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式: 。
。
II.(1)某同学运用所学知识,自选材料设计实验,实现了在通常条件下不能发生的反应:Cu+H2 S
S O4(稀)=CuSO4+H2↑。请你在右边方
O4(稀)=CuSO4+H2↑。请你在右边方 框内画出能够实现这一反应的装置图。
框内画出能够实现这一反应的装置图。
(2)某同学在做一定条件下铜与稀硫酸的反应实验时,
看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析
其原因:。
(2分)某造纸厂排出的废水,经取样分析其中 除了含有游离汞、纤维素以及其它的有机物外,其它成分为c (Na+)
除了含有游离汞、纤维素以及其它的有机物外,其它成分为c (Na+) = 4×10—4 mol/L,c (SO42—) = 2.5×10—4 mol/L,c (Cl—) =
= 4×10—4 mol/L,c (SO42—) = 2.5×10—4 mol/L,c (Cl—) =
1.6×10—5 mol/L,c (NO3—) = 1.4×10—5 mol/L,c (Ca2+) = 1.5×10—5 mol/L,则该废水的pH为__________。
(6分)如图是有关氮的循环示意图。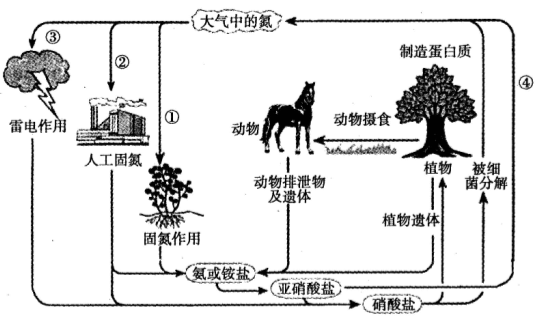
(1)过程①中通过的作用将空气中的氮气固定下来。
(2)请写出②中合成氨反应的化学方程式:。
(3)请写出③中固氮反应的方程式:。
(4)过程④中的亚硝酸盐有毒,工业上若直接排放将造成对环境的污染。已知NaNO2遇
到还原性较强的NH4+等被还原为N2。在废液中加入下列物质不能使NaNO2无害化
排放的是
a.H202 b.NH4CI c.KN03