Ⅰ. 在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72-+H2O  2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液后,溶液呈 色,因为 。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4后,则溶液呈 色,因为 。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡向 方向移动,溶液颜色将 。(填“变深”、“变浅”或“不变”)
Ⅱ.实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
1.配制100mL 0.10mol/L NaOH标准溶液。
2.取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。
3.重复上述滴定操作2~3次,记录数据如下。
| 实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) |
待测盐酸溶液的体积 (mL) |
| 1 |
0.10 |
22.62 |
20.00 |
| 2 |
0.10 |
22.58 |
20.00 |
| 3 |
0.10 |
22.60 |
20.00 |
(1)滴定达到终点的现象是 ,此时锥形瓶内溶液的pH范围为 。
(2)根据上述数据,可计算出该盐酸的浓度约为 。
(3)排去碱式滴定管中气泡的方法应采用下图 的操作,然后挤压玻璃球使尖嘴部分充满碱液。


甲 乙 丙
(4)在上述实验中,下列操作(其它操作正确)会造成测定结果偏高的有 (多选扣分)。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E.配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F.碱式滴定管尖嘴部分有气泡,滴定后消失
请按要求回答下列问题:
(1)新出土的青铜器若保存不善,在潮湿的环境中容易生成铜绿,该腐蚀过程中的负极反应式为:_________________________。
(2)惰性电极电解饱和Na2S溶液时,在阳极附近没有看到预期的浑浊现象,探究发现,其生成了Na2Sx,则阳极反应式为:_____________________。当阳极产生1mol Sx2-时,阴极产生的气体在标准状况下的体积为_________L。(用含x的代数式表示)
(3)合成氨工业中,天然气能代替煤用于生产原料气——H2,且反应类似。请写出天然气转化为H2的两步反应方程式:______________________________________,
___________________________________________。
(4)已知:
| 酸 |
电离常数(Ka) |
酸 |
电离常数(Ka) |
| CH3COOH |
1.8×10-5 |
HCN |
5×10-10 |
| H2CO3 |
Ka1= 4.2×10-7 |
HClO |
3×10-8 |
| Ka2= 5.6×10-11 |
①上述四种酸中,酸性最强的是;
②25℃时,0.01 mol/L NaCN溶液的pH________7;
③在浓度均为0.01 mol/L的CH3COONa、NaClO、Na2CO3的混合溶液中,逐滴加入0.01 mol/L HCl,则体系中酸根离子反应的先后顺序为;
④25℃时,向20mL 0.1 mol/L CH3COOH溶液中逐滴滴加0.1mol/L NaOH溶液,体系中各种量随着NaOH溶液的加入而变化的图像正确的是_____________。

AB

C D
“84”消毒液可用来消毒,已知某品牌“84”消毒液的有效成分为NaClO,另外还有较大量的Na2CO3、NaCl,为探究该消毒液的性质,某同学做了如下实验:取少量消毒液并向其中通入过量的CO2,再滴入品红,发现品红很快褪色。
(1)写出向溶液中通入过量的CO2所发生的两个离子方程式:
。(2)使品红很快褪色的物质是 。
(3)以该消毒液为主要来源可以制备较纯净的少量Cl2,具体操作分两个主要步骤:先向消毒液中加入过量的A试剂,静置后取上层清液,再加入了硫酸。(提醒:最后发生的反应为:NaCl + NaClO + H2SO4 = Cl2↑+ Na2SO4 +H2O)
① A试剂的化学式为_____________,其作用是 。
② 若生成标准标况下5.6 L Cl2,则转移电子的物质的量为____________。
(1)服用含碘化钾的碘药片可抗核辐射。将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色,试回答下列问题:
①溶液颜色由无色变蓝色的理由:(用离子反应方程式表示);
②完成并配平溶液颜色由蓝色变为无色的化学反应方程式(如果系数是1,不用填写):
+ + → HIO3 +
(2)观察如下反应,总结规律,然后完成下列问题:
(A) Al(OH)3+ H2O  Al(OH)4- + H+(B) NH3 + H2O
Al(OH)4- + H+(B) NH3 + H2O  NH4+ + OH-
NH4+ + OH-
①已知B(OH)3是一元弱酸,其电离方程式为;
②N2H4是二元弱碱,其电离方程式为。
(3)常温下,向1.0mol/L的NaHSO4溶液中逐滴加入等物质的量浓度的Ba(OH)2溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈(填“酸性”、“中性”、或“碱性”),c点所示的离子方程式为。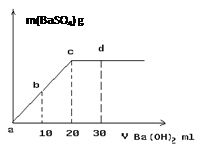
(4)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显性(填“酸性”、“中性”、或“碱性”);用含a的代数式表示NH3·H2O的电离常数Kb=。
(10分)(1)可逆反应N2(g)+3H2(g) 2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为。
2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为。
(2)除电解法,工业炼镁还可采用硅热法(Pidgeon法)。即以煅白(CaO·MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:
(CaO·MgO)(s) + Si(s)  Ca2SiO4 (l) + 2Mg(g)
Ca2SiO4 (l) + 2Mg(g)
①已知还原性:Mg > Si,上述反应仍能发生的原因是______________________________
②由右图,推测上述反应正向为______(填“吸热”或“放热”)反应;平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将______(填“升高” 、“降低”或“不变”)。
③若还原炉容积为400m3,原料中煅白质量为9.6 t,5小时后,测得煅白的转化率为50%,
计算这段时间Mg的生成速率 ___________。
(11分)A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示: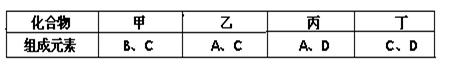
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物。请填写下列空白:
(1)丙物质的电子式为,丁物质中阴离子与阳离子的个数之比为。
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为QKJ,试写出表示甲物质燃烧热的热化学方程式。
(3)B、C两种元素按原子个数比为1:2可形成化合物戊,A、C、D三种元素按原子个数比为1:1:1可形成化合物己,则己与戊按物质的量之比为3:2完全反应后的溶液中各离子浓度的大小关系为。
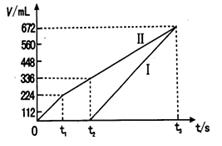
(4)某同学设计了一个以结构简式是BA3-CA物质为燃料的电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如下图: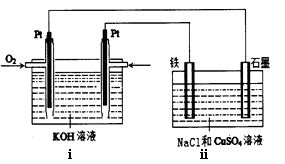
①写出ⅰ中通入该物质这一极的电极反应式。
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式;在t2时所得溶液的pH约为。