工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: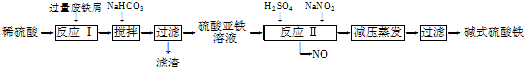
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)反应Ⅰ中发生的氧化还原反应的化学方程式为 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是______________________。
(3)反应Ⅱ的离子方程式为 ___。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作____ ____。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为____________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液
按要求写出下列化学方程式:
(1) 甲苯→TNT
;
(2)乙醇→乙烯
;
(3) 2-溴丙烷→丙烯
;
(4) CaC2→乙炔
(5)乙醛与银氨溶液在一定条件下发生的反应
有机物A的结构简式为:
据此回答下列问题:
(1)A的分子式为____________________。
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物。当有1 mol A发生反应时,最多消耗mol NaOH。
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简式为________________________________。
(4)写出苯环上只有一个取代基且属于酯类的D的所有同分异构体的结构简式:
。
二乙酸-1,4-环己二醇酯可通过下列路线合成:
(1)①的反应类型________, ②的反应类型________,
⑤的反应类型________, ⑦的反应类型________。
(2)试写出由 的所有反应的化学方程式:
的所有反应的化学方程式:
⑤______________________________________________________________,
⑥ ,
⑦ ,
⑧ 。
下列物质:①O2 ②三氯甲烷 ③CH3CH2CH2OH ④O3 ⑤CHCl3 ⑥CH3OCH2CH3
⑦C ⑧CH3CH(OH)CH3 ⑨C ⑩CH3OH。其中属于同系物的有________(填序号,下同),互为同分异构体的有________,互为同素异形体的有________,属于同位素的有________,是同一种物质的有________。
丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的工艺流程如下: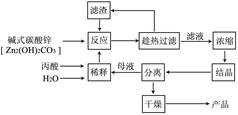
| 序号 |
n(丙酸)∶n(碱式碳锌) |
反应温度/℃ |
丙酸锌产率/% |
| 1 |
1∶0.25 |
60 |
67.2 |
| 2 |
1∶0.25 |
80 |
83.5 |
| 3 |
1∶0.25 |
100 |
81.4 |
| 4 |
1∶0.31 |
60 |
89.2 |
| 5 |
1∶0.31 |
80 |
90.1 |
| 6 |
1∶0.31 |
100 |
88.8 |
(1)探究本实验中最佳工艺条件(见上表):反应时间2h,用水量45g,n(丙酸)∶n(碱式碳酸锌)=1∶ ,反应温度 ℃。
(2)某次实验时,将37.0g丙酸溶于220mL水中,按上述流程在上述优化的条件下制备,最终得产品丙酸锌49.6g,则该次实验丙酸锌的产率为 。
(3)本工艺采用“闭路循环”方式,除具有制备工艺简便、产率高外,还具有 的优点。