装运浓硫酸的储运罐应贴的标志是
A. |
B. |
C. |
D. |
如图,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色.则下列说法正确的是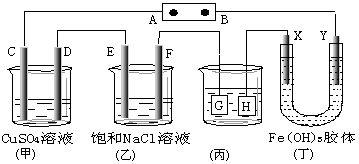
A.若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:O2+2H2O+4e-=4OH-
B.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
C.(丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
D.C、D、E、F电极均有单质生成,其物质的量比为1∶1∶2∶2
电子表所用的某种纽扣电池的电极材料为Zn和Ag2O,电解质溶液是KOH溶液。电池总反应式为:Zn+Ag2O=ZnO+2Ag,下列说法错误的是
| A.该电池工作时,电解质中的阴离子向负极移动 |
| B.该电池负极的电极反应式为:Zn+2OH--2e-=ZnO+H2O |
| C.理论上该电池工作一段时间后,溶液中KOH的浓度不变 |
| D.该电池的正极是Zn,负极是Ag2O |
下列有关AgCl沉淀的溶解平衡的说法中,正确的是
| A.升高温度,AgCl的溶解度减小 |
| B.在任何含AgCl固体的水溶液中,c(Ag+)=c(Cl-)且二者乘积是一个常数 |
| C.AgCl沉淀生成和溶解不断进行,但速率相等 |
| D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解的质量不变 |
下列溶液中离子浓度关系的表示正确的是
| A.NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) |
| B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)+c(CH3COO-) |
| C.0.1 mol·L-1的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-) |