某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为: ①取少量废液,滴加KSCN溶液显红色.②取10mL废液,加入足量的AgNO3溶液,析出沉淀8.61g.③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g,再向反应后的溶液中滴加KSCN溶液不变色.根据探究实验得出结论:
(1)废液中含有的金属离子是 。
(2)求10mL废液中氯离子的物质的量浓度?
(3)求10mL废液中铜离子的物质的量是 ?
铁及其化合物在日常生活、生产中应用广泛。研究铁及其化合物的应用意义重大。
I.水体的净化和污水的处理与铁及其化合物密切相关。
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理_______________。
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
①写出反应I中发生的氧化还原反应的离子方程式___________。
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为____________。
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为____________g。
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为___________。
II铁的化合物也是制备高能锂电池的重要原料。已知磷酸亚铁锂电池总反应为:
FePO4+Li LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。
(1)已知:
①C(s)+H2O(g)═CO(g)+H2(g) △H=+131.3kJ·mol﹣1
②CO2(g)+H2(g)═CO(g)+H2O(g) △H=+41.3kJ·mol﹣1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
该反应在 (填“高温”、“低温”或“任何温度”)下有利于正向自发进行.
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g) N2(g)+CO2(g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
 |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①10~20min内,N2的平均反应速率v(N2)= .
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是__________(填字母序号).
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol·L﹣1,在该条件下达到平衡时,CO的转化率为 .
(4)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.
①乙中A极产生的气体在标准状况下的体积为 .
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是 (填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要 mL 5.0mol·L﹣1 NaOH溶液.
(11分) 铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,同答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是________。(填序号)
A.纯铁硬度比生铁高
B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素
D.铁在一定条件下,可与水蒸气反应
E.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1mol L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为 ,所形成该分散系的微粒粒度范围是 。
L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为 ,所形成该分散系的微粒粒度范围是 。
(3)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路极。请写出FeCl3溶液与铜反应的离子方程式 。欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水,需要用到的一组试剂是_____________。
A.①②④ B.①③④⑥C.②④⑤D.①④⑥
(4)高铁酸钠(Na2FeO4)是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:2Fe(OH)3+3X+4NaOH=2Na2FeO4+3NaCl+5H2O,则X的化学式为 。
②高铁酸钠在水中可以发生如下反应:4FeO4 +10H2O==4Fe(OH)3+8OH
+10H2O==4Fe(OH)3+8OH +3O2↑。由此看来,高铁酸钠能够杀菌消毒是因为它具有___________性,而能够除去水中悬浮物是因为 。
+3O2↑。由此看来,高铁酸钠能够杀菌消毒是因为它具有___________性,而能够除去水中悬浮物是因为 。
③下列物质能用作净水剂的有___________。
a.KAl(SO4)2 l2H2O
l2H2O
b.聚合硫酸铁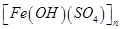
c.ClO2
d.“84”消毒液
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示: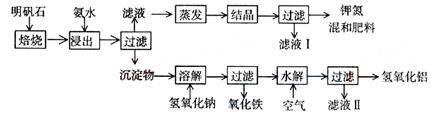
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。
配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有251.28g氨)__________mL,用规格为___________mL量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是: 。
(3)写出沉淀物中所有物质的化学式 。
(4)滤液I的成分是水和______________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量 溶液,产生白色沉淀。
②___________、__________、_________(依次填写实验操作名称)。
③冷却、称重。
(6)若试样为mg,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为: mol(用含有m、n的代数式表示)。
某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2﹣、SO42﹣、SiO32﹣、CO32﹣、Cl﹣中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.
(1)肯定不存在的离子是 .
(2)写出步骤②中生成沉淀和气体的反应的离子方程式: ; 。
(3)已知一定量的原溶液中加入5mL 0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl﹣? (填“有”或“无”).