下列说法正确的是( )
| A.ΔH<0、ΔS>0的反应在温度低时不能自发进行 |
| B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
| D.在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向 |
有Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250mL 2.00mol/L的NaOH溶液时,得到沉淀最多。上述盐酸溶液的浓度为()
| A.0.500mol/L | B.1.00mol/L | C.2.00mol/L | D.3.00mol/L |
将纯锌片和纯铜片按图示插入同浓度的稀硫酸中一段时间,以下叙述正确的是()
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速率甲比乙慢 |
二氧化氯(ClO2)是一种高效消毒剂,下列反应可制得ClO2:
2NaClO3 +Na2SO3 +H2SO4 = 2ClO2 +2Na2SO4 +H2O
对于该反应,下列说法正确的是()
| A.H2SO4发生氧化反应 | B.NaClO3是还原剂 |
| C.Na2SO4 是还原产物 | D.当转移1mol电子时,该反应生成1 mol ClO2 |
下列过程不能实现化学能转化为热能的是()
| A.二氧化硫催化氧化生成三氧化硫 | B.电解氯化钠水溶液 |
| C.铝粉与四氧化三铁反应 | D.铁与盐酸反应 |
绿色化学的核心是提高原子的利用率,最理想的“原子经济”是指原子利用率为100% 。下列有机反应中,原子利用率最高的反应是()
A.CH4+Cl2 CH3Cl+HCl CH3Cl+HCl |
B.nCH2=CH2 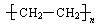 |
C. +HO—NO2 +HO—NO2  +H2O +H2O |
D.2CH3CH2OH+O2 2CH3CHO+2H2O 2CH3CHO+2H2O |