运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式________________。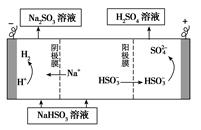
除杂提纯下列各物质,请写出所选化学试剂的化学式及反应的离子方程式。
| 混合物成分 |
化学试剂 |
离子方程式 |
| Na2SO4中含有少量Na2CO3杂质 |
||
| FeCl2中含有少量FeCl3杂质 |
||
| NaNO3中含有少量NaCl杂质 |
1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值: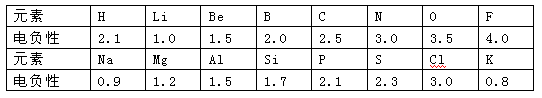
请仔细分析,回答下列有关问题:
①预测周期表中电负性最大的元素应为_____;估计钙元素的电负性的取值范围:< X <。
②根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是
;简述元素电负性X的大小与元素金属性、非金属性之间的关系。
③经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为。
在A、B、C、D四种元素中,A为地壳这含量最多的元素;B的单质在气体中密度最小;C元素的原子失去两个电子后,其电子层结构和氩原子相同;D元素的原子核外有三个能层,各能层电子数之比为1:4:1。
(1)写出上述四种元素的名称:A、B、C、
(2)写出C2+离子的电子排布式
(3)指出A、B、C三种元素中所形成的化合物中所包含化学键的类型
(10分)第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小(最小)范围为________<Al<________(填元素符号)。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是________。
(3)上图中第一电离能最小的元素在周期表中的位置是________。
(4)根据对角线规则,Be、Al元素最高氧化物的水化物性质相似,它们都具有________,
①原子序数为24的元素原子中有个能级,个价电子,个未成对电子。
②某元素原子的价电子构型为3S2,它是区元素,元素符号为。