下列离子方程式正确的是( )
| A.足量的CO2通入饱和碳酸钠溶液中: CO2+CO32-+H2O→2HCO3- |
B.FeSO4溶液在空气中变质:4Fe2++O2+2H2O 4Fe3++4OH- 4Fe3++4OH- |
| C.次氯酸钙溶液中通入足量二氧化硫:Ca2++ClO-+SO2+H2O→CaSO4↓+Cl-+2H+ |
| D.碳酸氢镁溶液中加入过量石灰水 Mg2++2HCO3-+2Ca2++4OH— ®2CaCO3↓+ Mg(OH)2↓+ 2H2O |
下列图示与对应的叙述相符的是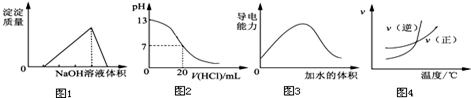
| A.图1表示向某硫酸和硫酸铝混合溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液体积的关系 |
| B.图2表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液的pH随加入盐酸体积的变化 |
| C.图3表示t℃时稀释冰醋酸过程中溶液导电性的变化 |
| D.根据图4可判断某可逆反应的正反应是吸热反应 |
CuI是一种不溶于水的白色固体,它可以由反应: 2Cu2++4I-=2CuI↓+I2而得到.如图所示装置中,a、b都是惰性电极,通电一段时间后,在KI-淀粉溶液中阳极周围变蓝色,则下列说法正确的是
| A.若a极变红,则在Pt电极上:2I--2e-=I2淀粉遇碘变蓝 |
| B.若b极变红,在Pt电极上:4OH--4e-=2H2O+O2O2将I-氧化为I2,淀粉遇碘变蓝 |
| C.若a极变红,在Cu电极上:Cu-2e-→Cu2+,2Cu2++4I-=2CuI↓+I2,一段时间后淀粉遇碘变蓝 |
| D.若b极变红,在Cu极上:Cu-2e-═Cu2+,Cu2+显蓝色 |
下列实验操作或原理不正确的是
| A.读取滴定管内液体体积时,俯视读数导致读数偏小 |
| B.分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 |
| C.纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 |
| D.进行焰色反应时,必须用稀硫酸洗涤并灼烧铂丝,然后再进行实验 |
下列溶液中微粒的物质的量浓度关系正确的是
| A.25℃时,pH=7的NH4Cl与NH3•H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) |
| B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.25℃时,pH=2的CH3COOH与pH=12的NaOH等体积混合: c(CH3COO-)+c(H+)<c(Na+)+c(OH-) |
| D.0.1mol/LNa2CO3溶液:2c(CO32-)+2c(HCO-)+2c(H2CO3)=c(Na+) |
如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说 法正确的是
| R |
||
| X |
Y |
Z |
A.X的氢化物比R的氢化物稳定
B.原子半径大小顺序是Z>Y>X
C.Y、R形成的化合物YR2能使KMnO4溶液褪色
D.X、Z可形成化合物XZ5,分子中各原子均满足最外层8电子结构