化学在绿色发展、循环发展、低碳发展及推进生态文明建设中正发挥着积极作用。下列做法与可持续发展宗旨相违背的是
| A.加大清洁能源的开发利用,提高资源的利用率 |
| B.推广碳捕集和储存技术,逐步实现二氧化碳零排放 |
| C.加大铅酸蓄电池、含汞锌锰干电池的生产,满足消费需求 |
| D.对工业废水、生活污水净化处理,减少污染物的排放 |
将0.4mol丁烷完全燃烧后生成的气体全部缓慢通入1L 2mol/LNaOH溶液中,生成的 Na2CO3和NaHCO3的物质的量之比为:
| A.3:2 | B.2:3 | C.2:1 | D.1:3 |
反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2 2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定。
2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定。
| c(H2)/(mol·L-1) |
c(Cl2)/(mol·L-1) |
v/(mol·L-1 ·s-1) ·s-1) |
| 1.0 |
1.0 |
1.0 k |
| 2.0 |
1.0 |
2.0 k |
| 2.0 |
4.0 |
4.0 k |
由此可推得,m、n值正确的是:
| A.m=1,n=1 | B.m=1/2,n=1/2 | C.m=1/2,n=1 | D.m=1,n=1/2 |
在2L的密闭容器中进行如下反应:X2(g)+2Y2(g) 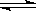 2Z(g),已知X2、Y2、Z的起始浓度分别为0.2mol/L、0.2mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是:
2Z(g),已知X2、Y2、Z的起始浓度分别为0.2mol/L、0.2mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是:
| A.Z为0.3mol/L | B.Y2为0.4mol/L | C.X2为0.1mol/L | D.Z为0.4mol/L |
根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W;Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为:
| A.X > Z > Y > W | B.Z > W > X > Y | C.Z > Y > X > W | D.Z > X > Y > W |
下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是:
| A.10℃ 20mL 4mol/L的盐酸溶液 | B.20℃ 30mL 2mol/L的硫酸溶液 2mol/L的硫酸溶液 |
| C.20℃ 40mL 1mol/L的硫酸溶液 | D.20℃ 50mL 3mol/L的盐酸溶液 3mol/L的盐酸溶液 |