下列有关实验装置的说法中正确的是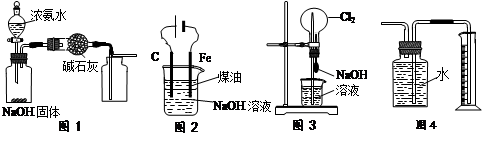
| A.用图1装置制取干燥纯净的NH3 |
| B.用图2装置实验室制备Fe(OH)2 |
| C.用图3装置可以完成“喷泉”实验 |
| D.用图4装置测量Cu与浓硝酸反应产生气体的体积 |
已知醋酸达到电离平衡后,改变某条件电离平衡向正反应方向移动,则下列说法正确的是
| A.实现该变化的只能是升高温度 | B.溶液的导电能力一定变强 |
| C.溶液的pH一定减小 | D.发生电离的分子总数增多 |
已知某温度下,几种酸的电离常数如下:Ka(HCN)= 6.2×10-10 mol/L、Ka(HF)= 6.8×10-4 mol/L、Ka(CH3COOH)= 1.8×10-5 mol/L、Ka(HNO2)= 6.4×10-6mol/L。则物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是
| A.NaCN | B.NaF | C.CH3COONa | D.NaNO2 |
可逆反应A(?)+aB(g)  C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示。下列说法不正确的是
C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示。下列说法不正确的是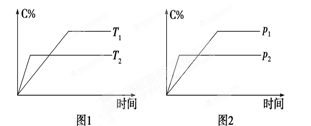
| A.若a=2,则A为液态或固体 |
| B.该反应的正反应为放热反应 |
| C.T2>T1,P2>P1 |
| D.其他条件不变,增加B的物质的量,平衡正向移动,平衡常数K增大 |
为证明某可溶性一元酸(HX)是弱酸,有如下实验方案,其中不合理的是
| A.室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸 |
| B.室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 |
| C.相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸 |
| D.将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 |
有等体积、等PH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
| A.V3>V2=V1 | B.V3=V2=V1 | C.V3>V2>V1 | D.V1=V2>V3 |