常温下,浓度均为0.1 mol/L的4种溶液pH如下表:
| 溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
| pH |
11.6 |
9.7 |
10.3 |
4.0 |
下列说法正确的是
A.0.1 mol/L Na2CO3溶液加水,稀释后溶液中所有离子的浓度均减少
B.NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.NaHSO3溶液中:c(Na+)>c(HSO3-) > c(H2SO3)>c(SO32-) > c(H+)>c(OH-)
D.向NaClO溶液中滴加硫酸至中性时,2c(SO42-)= c(HClO)
下列说法正确的是 ( )
| A.垃圾是污染物,一定条件下还可能产生二次污染 |
| B.堆肥法处理垃圾是最理想的垃圾处理方法 |
| C.废旧金属、玻璃等不属于垃圾 |
| D.没有绝对的垃圾,垃圾也可回收利用 |
节能减排对发展经济、保护环境有重要意义。下列措施不能减少二氧化碳排放的是
| A.利用太阳能制氢 | B.关停小火电企业 |
| C.举行“地球一小时”熄灯活动 | D.推广使用煤液化技术 |
钢铁生锈过程发生如下反应:①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O
=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O。下列说法正确的是
| A.反应①、②中电子转移数目相等 |
| B.反应①中氧化剂是氧气和水 |
| C.与铜质水龙头连接处的钢质水管不易发生腐蚀 |
| D.钢铁在潮湿的空气中不能发生电化学腐蚀 |
钢铁发生吸氧腐蚀时,正极上发生的电极反应为()
| A.2H++2e—→H2↑ | B.Fe2++2e—→Fe |
| C.2H2O+O2+4e—→4OH— | D.Fe3++e—→Fe2+ |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )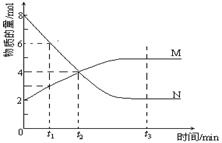
A.反应的化学方程式:2M N N |
| B.t2时,正、逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时N的浓度是M浓度的2倍 |