短周期元素X、Y、Z、W、Q在周期表中的相对位置如图所示。下列说法不正确的是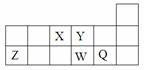
| A.离子半径的大小顺序为W>Q>Y>Z |
| B.X、Y、W三种元素的电负性大小顺序为X>Y>W |
| C.X、Z、W三种元素的最高价氧化物对应的水化物均能与强碱反应 |
| D.元素X的最简单氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
标准状况下,aL H2与Cl2的混合气体经光照后完全反应,H2+Cl2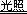 2HCl。所得气体恰好使bmol NaOH完全转变为盐,则a、b的关系不可能是()
2HCl。所得气体恰好使bmol NaOH完全转变为盐,则a、b的关系不可能是()
| A.b = a/22.4 | B.b < a/22.4 | C.b > a/22.4 | D.b ≥ a/11.2 |
标准状况下,1体积水可溶解448体积的HCl 气体,制得的盐酸溶液密度为1.2 g·mL-1, 所得溶液的物质的量浓度为()
| A.1.16 mol·L-1 | B.6.8 mol·L-1 | C.13.9 mol·L-1 | D.20.0 mol·L-1 |
VL Fe2(SO4)3 溶液中含有a g SO42-,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+ 的物质的量的浓度为()
A.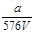 mol/L mol/L |
B.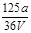 mol/L mol/L |
C.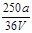 mol/L mol/L |
D.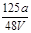 mol/L mol/L |
溶液中有0.2mol XO4—,加入0.3mol Na2SO3恰好反应,已知Na2SO3被氧化成Na2SO4,则还原产物中X的化合价为()
| A.0 | B.+1 | C.+3 | D.+4 |
在强碱性的无色透明溶液中可大量共存的离子组是()
| A.Mg2+、Na+、NO3―、SO42― | B.Na+、K+、NO3―、HCO3― |
| C.K+、Ba2+、Cl―、NO3― | D.Na+、Cl―、K+、MnO4― |