能正确表示下列反应的离子反应方程式为
| A.NH4HCO3溶于过量的浓KOH溶液中:NH4++ OH-= NH3↑+ H2O |
| B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -="2" Al(OH)3↓+3BaSO4↓ |
| C.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2="2" Fe3++2 Br2+6 Cl- |
| D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O |
下图是一种航天器能量储存系统原理示意图。下列说法正确的是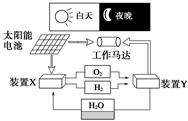
| A.该系统中只存在3种形式的能量转化 |
| B.装置Y中负极的电极反应式为O2+2H2O+4e-===4OH- |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd + 2NiOOH + 2H2O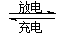 Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.放电时正极反应:NiOOH + H2O- e— ="=" Ni(OH)2 + OH-
B.充电过程是化学能转化为电能的过程
C放电时Cd是负极,发生氧化反应
D.放电时电解质溶液中的OH-向正极移动
下列图像分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是(ΔH用于表示反应中的热量变化,ΔH>0表示反应吸热 ,ΔH<0 表示反应放热)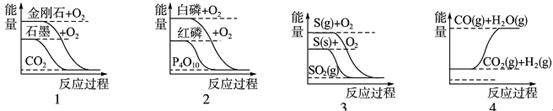
| A.石墨转变为金刚石是吸热反应 |
| B.白磷比红磷稳定 |
| C.S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)===SO2(g) ΔH2则ΔH1>ΔH2 |
| D.CO(g)+H2O(g)===CO2(g)+H2(g) ΔH1>0 |
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活动性相差越大,电压表的读数越大)依据记录数据判断,下列结论中正确的是
| 金属 |
电子流动方向 |
电压/V |
| 甲 |
甲→Cu |
0.78 |
| 乙 |
Cu→乙 |
0.15 |
| 丙 |
丙→Cu |
1.35 |
| 丁 |
丁→Cu |
0.30 |
A.金属乙能从硫酸铜溶液中置换出铜
B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀
C.在四种金属中,乙的还原性最强
D.甲、丁若形成原电池时,甲为正极
在一定条件下,使10molSO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),则下图中正确的是(M表示混合气体的平均相对分子质量)
2SO3(g),则下图中正确的是(M表示混合气体的平均相对分子质量)