有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:
甲:a(g)+b(g)  2c(g) ΔH1<0、 乙: x(g)+3y(g)
2c(g) ΔH1<0、 乙: x(g)+3y(g)  2z(g) ΔH2>0
2z(g) ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是( )
| A.绝热下向甲中通入惰性气体,c的物质的量不变 |
| B.绝热下向乙中通入z气体,反应器中温度升高 |
| C.恒温下向甲中通入惰性气体,甲中平衡不移动,乙中X、Y的转化率增大 |
| D.恒温下向乙中通入z气体,y的物质的量浓度增大 |
管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应:(在有水蒸气存在的条件下) 2NH3+3Cl2=6HCl+N2下列说法中错误的是()
| A.用该方法检验管道泄漏处会产生白烟 |
| B.管道泄漏处会闻到刺激性气味 |
| C.该反应生成1mol氮气时,转移3mol电子 |
| D.可以用浸有稀碱液的布包裹在管道泄漏处,暂时防止氯气的危害 |
试管中充满某气体后倒立于盛水的水槽中,试管中立即充满液体,结果如图所示,该试管中原来所装的气体可能是()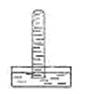
| A.CO2 | B.NO | C.NH3 | D.Cl2 |
在无色透明的强碱性溶液中,下列各组离子能大量共存的是()
| A.K+、 Ba2+、Cl—、NO3— | B.Na+、Cu2+、SO42—、NO3— |
| C.Mg2+、Na+、SO42—、Cl— | D.Na+、K+、NH4+、Cl— |
下列离子方程式中,正确的是()
| A.二氧化硫与氢氧化钠溶液反应: SO2+OH—=SO32—+H2O |
| B.硫酸与氢氧化钡溶液反应: H++OH—=H2O |
| C.二氧化氮与水反应: 3NO2+H2O=NO+2H++2NO3— |
| D.氧化铝与氢氧化钠溶液反应: Al2O3+2OH—=2AlO2—+H2 |
用NA表示阿伏加德罗常数的值。下列判断错误的是()
| A.NA个H+的质量为1 g |
| B.2 L 0.5mol/LNa2SO4溶液中含NA个Na+ |
| C.32 g O2中含有2NA个O原子 |
| D.标准状况下,1 mol H2O中含有NA个分子 |