下列有关0.2 mol·L-1 BaCl2溶液的说法中,不正确的是( )
| A.500 mL溶液中Cl-浓度为0.2 mol·L-1 | B.500 mL溶液中Ba2+浓度为0.2 mol·L-1 |
| C.500 mL溶液中Cl-总数为0.2 NA | D.500 mL溶液中Ba2+和Cl-总数为0.3NA |
检验试样中有无SO42-的操作及结论正确的是 ()
A.滴加硝酸酸化的AgNO3溶液没 有白色沉淀,一定没有SO42- 有白色沉淀,一定没有SO42- |
| B.加HCl酸化的BaCl2有白色沉淀,一定有SO42- |
| C.先加HCl无明显现象,再加BaCl2有白色沉淀,一定有SO42- |
| D.滴加BaCl2有白色沉淀,一定有SO42- |
下列反应中,不属于化合反应、分解反应、置换反应、复分解反应的是( )
A CaCO3+CO2+H2O===Ca(HCO3)2
B 4FeS2+11O2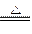 2Fe2O3+ 8SO2
2Fe2O3+ 8SO2
C Cu2(OH)2CO3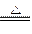 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
D CuSO4+Na2S===CuS↓+Na2SO4
根据厦门气象台报道,近年每到春季,厦门市经常出现大雾天气,致使高速公路关闭,航班停飞。雾属于下列分散系中的  ()
()
| A.溶液 | B.悬浊液 | C.乳浊液 | D.胶体 |
相同温度和压强下,3体积X2气体和6体积Y2气体化合生成6体积气态化合物,则生成物的化学式为()
| A.XY | B.X3Y2 | C.X2Y3 | D.XY2 |
下列物质可直接反应生成盐的是 ()
()
①金属 ② 碱性氧化物 ③ 碱 ④ 非金属 ⑤ 酸性氧化物 ⑥酸
A.只有①②③ B 只有①④⑥ C 只有②⑤⑥ D 全部