在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如下图所示,由此确定,原溶液中含有的阳离子是
| A.Mg2+、Al3+、Fe2+ | B.H+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ | D.只有Mg2+、Al3+ |
下列对化学反应的表示正确的是( )
A.用铜作电极电解硫酸铜溶液的离子方程式:2Cu2++2H2O 4H++2Cu+O2↑ 4H++2Cu+O2↑ |
| B.含氢氧化钠20.0 g的稀溶液与足量盐酸反应放出28.7 kJ的热量,热化学方程式:NaOH(aq)+ HCl(aq)====NaCl(aq)+H2O(l)ΔH="-28.7" kJ·mol-1 |
C.碳酸氢钙溶液中加入过量饱和氢氧化钙溶液的离子方程式:Ca2++ +OH-====CaCO3↓+H2O +OH-====CaCO3↓+H2O |
D.稀硝酸与过量铁粉反应的离子方程式:3Fe+8H++2 ====3Fe3++2NO↑+4H2O ====3Fe3++2NO↑+4H2O |
pH=2的盐酸与pH=12的氨水等体积混合后,溶液中离子浓度大小顺序正确的是( )
A.[Cl-]>[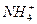 ]>[OH-]>[H+] ]>[OH-]>[H+] |
B.[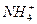 ]>[Cl-]>[OH-]>[H+] ]>[Cl-]>[OH-]>[H+] |
C.[Cl-]>[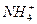 ]>[H+]>[OH-] ]>[H+]>[OH-] |
D.[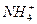 ]>[Cl-]>[H+]>[OH-] ]>[Cl-]>[H+]>[OH-] |
某溶液中由水电离产生的[H+]等于10-10 mol·L-1,该溶液的溶质不可能的是( )
| A.Ca(OH)2 | B.NH3·H2O | C.CH3COONa | D.Fe(NO3)3 |
下面是关于中和滴定的实验叙述:取25 mL未知浓度的HCl溶液。在横线标明的操作中,有错误的是( )
a.放入锥形瓶中,此瓶需事先用蒸馏水洗净。
b.并将该瓶用待测液润洗过。
c.加入几滴酚酞作指示剂。
d.取一支酸式滴定管,经蒸馏水洗净。
e.直接往其中注入标准NaOH溶液,进行滴定。
f.一旦发现溶液由无色变成粉红色,即停止滴定,记下数据。
| A.d、e、f | B.b、d、e、f | C.b、d、e | D.b、c、e、f |
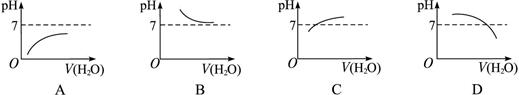
能表示人大量喝水时胃液的pH变化的图象是( )