在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是
| A.向氯水中加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 |
| B.溶液呈浅黄绿色,且有强烈刺激性气味,说明有Cl2分子存在 |
| C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明溶液中有Cl-存在 |
| D.加入NaOH溶液,氯水浅黄绿色消失,说明有HClO分子存在 |
“甲型H1N1”流感疫情已构成“具有国际影响的公共卫生紧急事态”。已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性,其分子结构如图所示。
下列说法正确的是
| A.该物质的分子式为C12H20N4O7 |
| B.1mol该物质与NaOH溶液反应,可以消耗4molNaOH |
| C.在一定条件下,该物质可以发生消去、加成、取代等反应 |
| D.该物质能使溴水或高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应 |
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+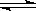 AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。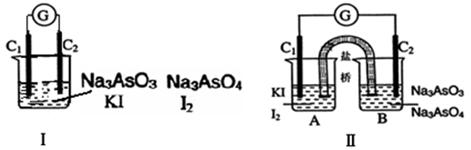
下列叙述中正确的是
| A.甲组操作时,微安表(G)指针发生偏转 |
| B.甲组操作时,溶液颜色变深 |
| C.乙组操作时,C2做正极 |
| D.乙组操作时,C1上发生的电极反应为I2 +2e-=2I- |
在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mf2+等离子,已知:
Ksp[Fe(OH)3]=2.6×10-39;Ksp[Cr(OH)3]=7.0×10-31
Ksp[Zn(OH)2]=1.0×10-17;Ksp[Mg(OH)2]=1.8×10-11
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
| A.Fe3+ | B.Cr3+ | C.Zn2+ | D.Mg2+ |
已知在酸性条件下能发生下列反应:Cu+→Cu+Cu2+(未配平)。NH4CuSO3与足量的10 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是
| A.该反应显示硫酸具有酸性 |
| B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 |
| D.反应中硫酸作氧化剂 |
下列离子方程式书写正确的是
| A.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-= BaSO4↓+H2O |
| B.NaClO溶液与FeCl2溶液混合:Fe2+ + 2ClO- + 2H2O= Fe(OH)2↓ + 2HClO |
| C.NH4HSO3溶液与足量NaOH溶液反应:NH4+ + OH-= NH3↑ + H2O |
| D.将1mol/L NaAlO2溶液和1.5mol/L的HCl溶液等体积互相均匀混合: |
6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+