可逆反应mA(固)+nB(气) eC(气)+fD(气),反应过程中保持其他条件不变,C的体积分
eC(气)+fD(气),反应过程中保持其他条件不变,C的体积分
数[j(C)]在温度(T)和压强(P)的条件下随时间(t)变化如下图所示,下列叙述正确的是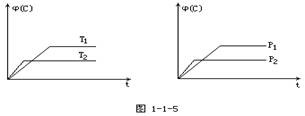
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.达到平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
在BaSO4饱和溶液中加入少量BaCl2溶液时产生沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中
A.c(Ba2+)=c(SO42-)=(Ksp)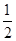 |
| B.c(Ba2+)·c(SO42-)=Ksp,c(Ba2+)>c(SO42-) |
| C.c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-) |
| D.c(Ba2+)·c(SO42-)≠Ksp,c(Ba2+)<c(SO42-) |
某混合溶液中含有KCl、 KBr、 K2CrO4, 其浓度均为0.01mol·L-1, 向溶液中逐滴加入0.01mol·L-1AgNO 3溶液时,最先和最后沉淀的物质分别是(AgCl 、AgBr 、Ag2CrO4的 Ksp分别为1.77 ×10-1 0、 5.35×1 0-1 3、1.12×1 0-1 2)
| A.AgBr 、AgCl | B.Ag2CrO4、AgCl |
| C.AgBr 、Ag2CrO4 | D.同时沉淀 |
向体积为Va的0.05 mol·L-1 CH3COOH溶液中加入体积为Vb的0.05 mol·L-1 KOH溶液,下列关系错误的是
| A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+) |
| B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-) |
| C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+) |
| D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
25 ℃时,取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
| A.0.01 mol·L-1 | B.0.017 mol·L-1 |
| C.0.05 mol·L-1 | D.0.50 mol·L-1 |
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
| 化学式 |
电离常数 |
| HClO |
Ka=3×10-18 |
| H2CO3 |
Ka1=4.3×10-7 |
| Ka2=5.6×10-11 |
A.c(HCO3-)>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO3-)>c(H+)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)