合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) |
360 |
440 |
520 |
| K值 |
0.036 |
0.010 |
0.0038 |
(1)①写出工业合成氨的化学方程式_________________________________________。
②由上表数据可知该反应为放热反应,理由是_____________________________________。
③理论上,为了增大平衡时H2的转化率,可采取的措施是。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g) + H2O (g) CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的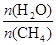 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: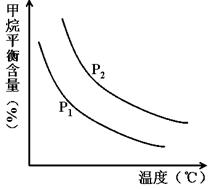
①图中,两条曲线表示压强的关系是:P1________P2(填“>”、“=”或“<”)。
②该反应为_____________反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) + H2O(g) CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为______,该温度下反应的平衡常数K值为_________。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____________(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6
(17分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)  2NH3(g)△H=" -92.4" kJ/mol,据此回答以下问题:
2NH3(g)△H=" -92.4" kJ/mol,据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是(填序号)。
①反应压强为20Mpa~50Mpa
②500℃的高温
③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2T1(填>、=、<),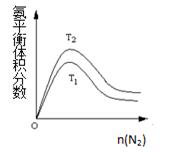
判断的依据是:。
(3)合成氨气所需的氢气可以由水煤气分离得到。
涉及反应信息如下:
反应一:C(s)+H2O(g)  H2(g)+CO(g)平衡常数K1
H2(g)+CO(g)平衡常数K1
反应二:CO(g)+H2O(g)  H2(g)+CO2(g)平衡常数K2
H2(g)+CO2(g)平衡常数K2
①K1的表达式:K1=。
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
1 |
2 |
0.8 |
1.2 |
5 |
| 2 |
900 |
0.5 |
1 |
0.2 |
0.8 |
3 |
| 3 |
T |
a |
b |
c |
d |
t |
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为。
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为(填序号)
A.其它条件不变温度T<900℃ B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2(填“增大”、“减小”或“不变”)。
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯: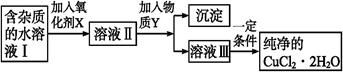
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+ |
Fe2+ |
Cu2+ |
|
| 氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题:
(1)加入氧化剂的目的是。
(2)最适合作氧化剂X的是。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y是。
(4)若不用物质Y而是直接用碱能不能达到目的?(填“能”或“不能”)。若不能,试解释原因。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?(填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作?。
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是。
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是,上述四种离子浓度的大小顺序为(填序号)________________。
(2)若四种离子的关系符合③,则溶质为;若四种离子的关系符合④,则溶质为。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图象正确的是(填图象符号)________。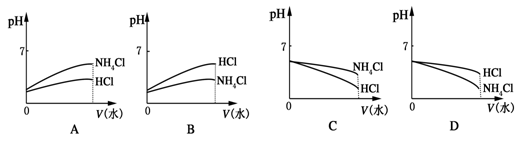
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”)。
(12分)某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.已知该反应中H2O2只发生如下过程:H2O2 O2
O2
(1)该反应中的还原剂是
(2)该反应中,发生还原反应的过程是
(3)写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目:
(4)若反应转移了0.3mol电子,则产生的气体在标准状况下体积为L
(8分)
(1)下列每组物质中都有一种与其它三种不同类,找出这种物质将其化学式写在后面的横线上:
①NaCl、NaI、Na2CO3、NaBr:_________
②CH3COOH、HCl、HNO3、H2SO4:
③Al(OH)3、Ba(OH)2、Fe(OH)3、NH3·H2O:
④CO2、SO2、CaO、Mn2O7:
(2)同温、同压时质量相等的O2和O3相比较,其物质的量之比为________,体积之比为______密度之比为________,所含氧原子数之比为_________