一定条件下,可逆反应N2 +3H2 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是()
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是()
| A.加催化剂,V正、V逆 都发生变化,且变化的倍数相等 |
| B.加压,V正、V逆 都增大,且V正 增大的倍数大于V逆 增大的倍数 |
| C.降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数 |
| D.增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数;N2 转化率减小,H2转化率增大 |
25℃时的下列五种溶液中,水的电离程度由大到小排列顺序正确的是
| 溶质 |
HCl(aq) |
FeCl3 |
NaOH |
HCOONa |
C2H5OH |
| 溶液的pH |
3 |
4 |
10 |
11 |
未测定 |
| 水的电离程度 |
α1 |
α2 |
 α3 α3 |
α4 |
α5 |
A.α3>α1>α5>α4>α2 B.α4>α2>α5>α3>α1
C.α2>α4>α5>α1>α3 D.α1>α3>α5>α2>α4
已知热化学反应方程式:
Zn(s)+ O2(g)
O2(g) ZnO(s);ΔH="-351.5" kJ·mol-1
ZnO(s);ΔH="-351.5" kJ·mol-1
Hg(l)+ O2(g)
O2(g)  HgO(s);ΔH
HgO(s);ΔH  ="-90.84" kJ·mol-1
="-90.84" kJ·mol-1
则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)  ZnO(s)+Hg(l)的ΔH为
ZnO(s)+Hg(l)的ΔH为
| A.ΔH="+260.7" kJ·mol-1 | B.ΔH="-260.7" kJ·mol-1 |
| C.ΔH="-444.2" kJ·mol-1 | D.ΔH="+444.2" kJ·mol-1 |
一定温度下,在密闭容器中可逆反应.N2(g)+3H2(g)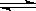 2NH3(g)达到平衡状态,此时N2的转化率为20%,H2的转化率为50%,则平衡时体系的压强为反应前的()
2NH3(g)达到平衡状态,此时N2的转化率为20%,H2的转化率为50%,则平衡时体系的压强为反应前的()
| A.1/5 | B.3/4 | C.9/11 | D.1/2 |
下列热化学方程式中,△H能正确表示物质的燃烧热的是()
A.CO(g) +1/2O2(g) ==CO2(g); △H=-283.0 kJ/mol
B C(s) +1/2O2(g) ="=CO(g);" △H=-110.5 kJ/mol
+1/2O2(g) ="=CO(g);" △H=-110.5 kJ/mol
C. H2(g) + 1/2O2(g)==H2O(g); △H=-241.8 kJ/mol
1/2O2(g)==H2O(g); △H=-241.8 kJ/mol
D.2C8H18(l) +25 O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol
O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol