已知A原子只有一个未成对电子,M电子层比N电子层多11个电子,试回答下列问题:
(1)该元素的基态原子有 个能层充有电子;
(2)写出A原子的电子排布式和元素符号 ; 。
(3)指出元素A在周期表中的位置 。
(4)指出元素A的最高化合价 。
(5)A的氢化物分子中共价键的类型可能有 。
①s-pσ键 ②p-pσ键 ③s-s σ键 ④p-pπ键
为提纯含NaCl和Na2SO4两种杂质的NaNO3溶液,且逐一分离出杂质,某同学设计了如下的实验流程: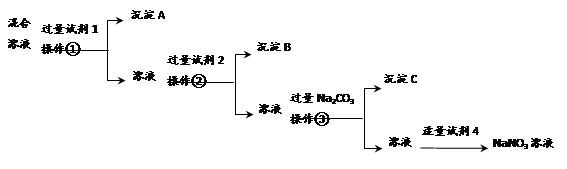
(1)操作①②③的名称都是________(填操作名称)。
(2)写出试剂的名称:试剂1___________;试剂2_____________。
(3)操作③之前加入Na2CO3的目的是________________________。
(4)加入试剂4后,发生反应的离子方程式为_________________。
控制试剂4的加入量“适量”的方法是_____________________。
元素周期表是指导化学学习的重要工具。下图为元素周期表的一部分。请按要求填空。
| N |
F |
|||||
| Mg |
Al |
S |
Cl |
(1)N在元素周期表中的位置是_____;N和F处于同一行,是由于它们的_________相同。
(2)以上元素中,原子半径最小的是_____(写元素符号);最高价氧化物对应水化物中酸性最强的是__________(写化学式)。
(3)Mg和Al中,金属性较强的是_______(写元素符号),写出一条能说明该结论的事实____________________。
(4)S和Cl中,非金属性较强的是_____(写元素符号),不能说明该结论的事实是_____。
a.氯气与铁反应生成FeCl3,硫与铁反应生成FeS
b.把Cl2通入H2S溶液中能发生置换反应
c.受热时H2S易分解,HCl不易分解
d.单质硫是固体,氯的单质是气体
有三瓶无色溶液的标签损坏了,只知道它们分别是盐酸、BaCl2溶液和Na2CO3溶液。甲、乙两位同学各用一种试剂,一次性鉴别都取得了成功。甲用的一种指示剂是_________;乙用的一种酸溶液是__________。丙同学没用任何试剂也鉴别成功了,他的鉴别过程是:取样于试管中,编号为a、b、c,然后将三种溶液两两混合,发现a加入b中有气泡产生,a加入c中有白色沉淀产生,则a、b、c分别是________、________、__________。
铝可以制成铝箔是利用了铝的____________性;铝比铁不容易生锈的原因是铝表面较易形成__________。工业上可用铁槽车运输浓硫酸,是由于常温下浓硫酸能使铁_________。铁与水蒸气反应的化学方程式为__________________________。
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
已知:Cu2O+2H+═Cu+Cu2++H2O
(1)固体混合物B与氢氧化钠溶液反应的化学方程式为。
(2)滤液A中铁元素的存在形式只能为Fe2+,理由是
。涉及的离子方程式为、
(不必书写Cu2O与盐酸的反应)。检验滤液A中Fe2+的试剂为(填试剂名称)。
(3)将滤液C中的铝元素以沉淀形式析出,可选用的最佳试剂为 __ (填序号)。
| A.氢氧化钠溶液 | B.硫酸溶液 | C.氨水 | D.二氧化碳 |
金属E与固体F某一成分发生的反应可用于焊接钢轨,该反应的化学方程为。