关于Na2CO3和NaHCO3性质的说法正确的是
| A.等浓度时水溶液碱性:NaHCO3>Na2CO3 |
| B.热稳定性:NaHCO3>Na2CO3 |
| C.与盐酸溶液反应的速率(快慢):NaHCO3<Na2CO3 |
| D.向饱和 Na2CO3溶液中通入过量CO2,有晶体析出 |
标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg·cm-3。下列说法错误的是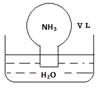
| A.水最终会充满整个烧瓶 |
| B.所得溶液的物质的量浓度为1/22.4 mol·L-1 |
| C.所得溶液的质量分数为17/22400ρ |
| D.所得溶液中,n(NH3·H2O)+n(NH4+)="V/22.4" mol |
有下列两种转化途径,某些反应条件和产物已省略,下列有关说法不正确的是
途径①: 途径②:
途径②: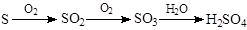
| A.途径①反应中体现了浓硝酸的强氧化性和酸性 |
| B.途径②的第二步反应在实际生产中可以通过增大O2浓度来提高产率 |
| C.由途径①和②分别制取1mol H2SO4,理论上各消耗1mol S,各转移6mol电子 |
| D.途径②与途径①相比更能体现“绿色化学”理念,是因为途径②比途径①污染相对小且原子利用率高 |
某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为x。则 表示的是
表示的是
| A.V L该气体的质量(以g为单位) | B.1 L该气体的质量(以g为单位) |
| C.1 mol该气体的体积(以L为单位) | D.1 L该气体中所含的分子数 |
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
KNO3的溶解度大 |
用重结晶法除去KNO3中混有的NaCl |
| B |
BaSO4难溶于酸 |
用盐酸和BaCl2溶液检测SO42- |
| C |
NH3能使酚酞溶液变红 |
NH3可用于设计喷泉实验 |
| D |
Ca(OH)2能制成澄清石灰水 |
可配制2.0 mol·L-1的Ca(OH)2溶液 |
下列有关溶液的说法正确的是
| A.要配制浓度为0.25mol·L-1的NaOH溶液480mL,应称量4.8g NaOH在250mL的烧杯中溶解,冷却,再转移到500mL容量瓶中,洗涤、转移、定容 |
| B.配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏低 |
| C.配制一定物质的量浓度的溶液定容时,俯视刻度线导致所配浓度偏高 |
| D.配制20g密度为ρg·cm-3的Ca(NO3)2溶液中含有2g Ca(NO3)2,则溶液中NO3-的物质的量浓度为5ρ/41mol·L-1 |