下列各组离子一定能大量共存的是
| A.在强碱性溶液中: NH4+、Na+、NO3-、CO32- |
| B.能使紫色石蕊试液变蓝的溶液中:Ca2+、Fe2+、AlO2-、Cl- |
| C.某无色溶液中:Cu2+、Al3+、NO3-、SO42- |
| D.含有大量H+的溶液中:Na+、K+、Al3+、NO3- |
己知:HCN(aq)与NaOH(aq)反应的∆H= —12.1kJ/mol;HCl(aq)与NaOH(aq)反应的
∆H= —55.6kJ/mol。则HCN在水溶液中电离的∆H等于
| A.—67.7 kJ/mol | B.—43.5 kJ/mol | C.+43.5 kJ/mol | D.+67.7kJ/mol |
下列反应的离子方程式书写正确的是
| A.CH3COOH溶液与NaOH溶液反应:CH3COOH + OH— = CH3COO— + H2O |
B.硫氢化钠水解:HS— + H2O 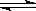 H3O+ + S2— H3O+ + S2— |
| C.NaHCO3溶液与NaOH溶液反应:HCO3— + OH— = CO2↑ + H2O |
| D.FeCl3溶液与Na2S溶液反应:2Fe3+ + 3S2— + 6H2O = 2Fe(OH)3↓ + 3H2S↑ |
X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X + 2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为5:2,则Y的转化率最接近于
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为5:2,则Y的转化率最接近于
| A.33% | B.40% | C.50% | D.65% |
下列说法或表示方法正确的是
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ |
| C.由C(石墨)= C(金刚石);△H=" +1.90" kJ/mol可知,金刚石比石墨稳定 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:
2SO2+O2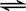 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能小于n的是
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能小于n的是
| A.2 mol SO2+ 1 mol O2 |
| B.4 mol SO2+ 1 mol O2 |
| C.2 mol SO2+ 1 mol O2+ 2mol SO3 |
| D.3 mol SO2+ 1 mol O2+ 1 molSO3 |