Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用
化学方程式表示如下:2FeSO4 + 6Na2O2= 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑
对此反应下列说法中正确的是( )
| A.Na2O2只作氧化剂 | B.Na2FeO4既是氧化产物又是还原产物 |
| C.O2是还原产物 | D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移 |

 有关下图所示化合物的说法不正确的是
有关下图所示化合物的说法不正确的是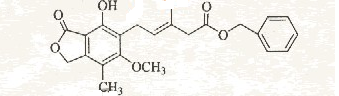
| A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 |
| B.1mol该化合物最多可以与3molNaOH反应 |
| C.既可以催化加氢,又可以使酸性KmnO4溶液褪色 |
| D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
我国在反兴奋剂问题上的立场是坚决支持“人文奥运”的。某种兴奋剂的结构如下图所示。关于它的叙述正确的是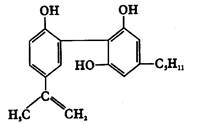
| A.它的分子式为C20H22O3 |
| B.它易溶于水 |
| C.它的分子中共平面的碳原子最多有16个 |
| D.1mol它最多可与7molH2和含4mol Br2的溴水发生反应 |
已知1mol某态烃CmHn完全燃烧时,需要耗氧气5mol ;则m与n的下列关系正确的是 ()
A.m=8+n B m=10-n C m=5-n/4 D、m=12-n
仔细分析下列表格中烃的排列规律,判断排列在第15位烃的分子式是
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
…… |
| C2H2 |
C2H4 |
C2H6 |
C3H4 |
C3H6 |
C3H8 |
C4H6 |
C4H8 |
C4H10 |
…… |
A C6H12 B C6H14 C C7H12 D C7H14
蛋白质受某些理化因素的影响,其空间结构发生变化,引起理化性质和生物活性的变化,称为蛋白质的()
| A.水解 | B.盐析 | C.变性 | D.聚沉 |