NaCl的晶胞如图所示,将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成C原子,再在晶胞的4个“小立方体”中心处各放置一个C原子,且这四个“小立方体”互不共面,位于“小立方体”中的碳原子均与最近的4个碳原子成键,以此表示金刚石的一个晶胞。若再将在成键的C原子中心联线的中点处增添一个O原子,则构成了某种CO2的晶胞。则下面说法正确的是( )(已知C-C键的键长1.54×10-10m)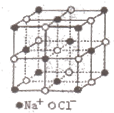
| A.一个金刚石的晶胞中有8个C原子 |
| B.金刚石的密度为3.54g·cm-1 |
| C.在该种CO2晶体中,一个CO2分子由一个C原子和二个氧原子构成 |
| D.在该种CO2晶胞中含氧原子8个 |
下列溶液,加热后颜色一定变浅的是
| A.稀氨水和酚酞溶液 | B.滴有酚酞的Na2CO3溶液 |
| C.滴有酚酞的氢氧化钙溶液 | D.溶有SO2的品红溶液 |
下列指定反应的离子方程式正确的是
| A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| B.Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH- |
| C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O |
| D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
下列物质性质的变化规律,与共价键键能大小有关的是
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高
②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石的硬度、熔点、沸点都高于晶体硅
④NaF、NaCl、NaBr、NaI的熔点依次降低
| A.仅③ | B.①③ | C.②③ | D.②③④ |
某晶体中含有极性键,关于该晶体的说法错误的是
| A.不可能有很高的熔沸点 | B.不可能是单质 |
| C.可能是有机物 | D.可能是离子晶体 |
下列表示对应化学反应的离子方程式正确的是
| A.向稀HNO3中滴加Na2SO3溶液:SO32—+2H+=SO2↑+H2O |
| B.向Na2SiO3溶液中通入过量SO2:SiO32—+ SO2+ H2O=H2SiO3↓+SO32— |
| C.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4NH3·H2O=[Al(OH)4]—+4NH4+ |
| D.向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ |