铜是生物必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式____________________________________________________。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式__________________________________________________。
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+ Cu2S 6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜诱的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式__________________________。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取ag试样配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式________________________________________。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为:I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗cmol/L的Na2S2O3溶液VmL。则试样中CuSO4·5H2O的质量分数为____________。
Ⅰ、钨是我国丰产元素,是熔点最高的金属 , 广泛用于拉制灯泡的灯丝 , 有“光明使者”的美誉。钨在自然界主要以钨 (+6价) 酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。白钨矿的主要成分是钨酸钙 (CaWO4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe,Mn)WO4,钨酸(H2WO4)酸性很弱,难溶于水。黑钨矿传统冶炼工艺的第一阶段是碱熔法: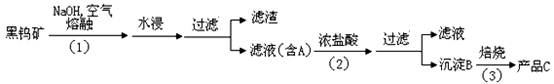
其中 A、B、C 都是钨的化合物。回答:
(1)74W在周期表的位置是第周期。
(2) 写出上述流程中B 、C 的化学式:B____________; C_____________
(3) 钨冶炼工艺的第二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。对钨的纯度要求不高时 , 可用碳作还原剂。写出用碳还原氧化钨制取金属钨的化学方程式:______________________________________________________________;
(4) 仲钨酸的阱盐在热分解时会发生内在氧化还原反应 ,我国钨化学研究的奠基人顾冀东先生采用这一反应制得了蓝色的、非整比的钨氧化物 WO3-x。这种蓝色氧化钨具有比表面大、易还原的优点 , 在制钨粉时温度容易控制 ,目前冶炼拉制钨丝的金属钨都用蓝色氧化钨为原料。经分析 , 得知蓝色氧化钨中钨的质量分数为 0.7985,X=0.1。一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态的钨。则蓝色氧化钨中这两种价态的钨原子数比为________:________.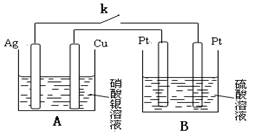
Ⅱ、如上图所示,当关闭电键k一段时间,发现Ag棒与 Cu棒质量差为28g时,则装置B产生气体的总质量为g(电解质溶液足量)。
现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 |
OH—、Cl—、CO32—、NO3—、SO42— |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)A溶液呈碱性的原因是。
(2)写出E溶液与过量的B溶液反应的离子方程式。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H=" —a" kJ·mol-1。
请写出相同条件下B与C的稀溶液反应的热化学方程式。
(4)若25°时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度倍。
(5)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中一价离子(+1或一1)浓度由大到小的顺序为:。
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
④ |
||||||
| 3 |
⑤ |
③ |
⑥ |
⑦ |
(1)④、⑤、⑦的原子半径由大到小的顺序为___________。
(2)⑥和⑦的最高价含氧酸的酸性强弱为_____>_______。
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为__________。在酸性溶液中该物质能将Fe2+氧化,写出该反应的离子方程式____________。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。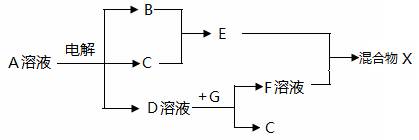
①写出D溶液与G反应的化学方程式____________。
②写出检验A溶液中溶质的阴离子的方法: ____________。
③常温下,若电解1 L 0.1 mol/L A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为__________ mol。
④若上图中各步反应均为完全转化,则混合物X中含有的物质有_______。
氮及其化合物与人们的生活息息相关。
(1)氮元素在周期表中的位置是。
(2)实验室可用铜与稀硝酸反应制取NO,其离子方程式是。为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该化学方程式是。
(3)已知:① CH4(g) + 4 NO2(g) =" 4" NO(g) + CO2(g) +2 H2O(g)△H= -574 kJ·mol-1
② CH4(g) + 4 NO(g) =" 2" N2(g) + CO2(g) + 2 H2O(g)△H= -1160 kJ·mol-1
根据①和②,标准状况下,4.48 L CH4恰好将NO2转化为N2时,△H=。
由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H-574 kJ·mol-1
(4)同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气完全转化为N2,则原混合
气中 NO和NO2的体积比是 。
(5)含有1mol HNO3的稀硝酸分别与不同质量的铁粉,所得氧化产物a、b与铁粉物质的量关系如下图所示。 b是n3 =p=
某化学小组探究液体有机物样品A(C3 H8 O2)的结构,进行如下实验。
实验I:用右图实验装置,通过Na与A反应确定羟基个数。
试回答下列问题:
(1)有机物A从(填仪器名称)中加入;检验装置甲的气密性的方法是。
(2)实验前预先将小块钠在二甲苯中熔化成若干个小球并冷却后再与有机物A反应,其目的是。
(3)实验数据记录如下:p="l.038" g·mL-1
| 实验编号 |
有机样品的体积 |
有机样品的质量 |
生成气体的体积(标准状况下) |
| I |
3.65mL |
3.8g |
1120mL |
| II |
7.30mL |
7.6g |
2240mL |
| III |
14.60mL |
15.2g |
4000mL |
①不能选第组数据来计算A中羟基个数,这组数据出现错误的原因可能是,(填两条)。
②有机物A中羟基个数为。
实验Ⅱ:
欲确定有机物A中含氧官能团的位置,进行如下实验:
①取7.30 mL A,Cu作催化剂,经氧化后完全转化成液态有机物B。
②取一质量为m1g的洁净试管,向其中加入足量银氨溶液,滴人化合物B,并水浴加热,待充分反应后,静置,小心倒出上层清液,向试管中小心滴加蒸馏水,倒出,再加入蒸馏水,再倒出,最后将试管烘干并称量。重复2次,试管质量均为m2g。
试回答下列问题:
(1)步骤②中小心滴加蒸馏水的目的是。
(2)若 则有机物A的结构简式是。
则有机物A的结构简式是。
(3)步骤②中,不宜将银氨溶液换成新制氢氧化铜溶液的原因是。