下列离子能在溶液中大量共存,当将溶液的pH调节至1时就会出现浑浊的是
| A.Fe2+、Fe3+、NH4+、NO3- | B.S2-、K+、I-、SO32- |
| C.Na+、I-、CO32-、NO3- | D.Al3+、HCO3-、OH-、Na+ |
下列说法中正确的是
| A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 |
B.AgCl悬浊液中存在平衡:AgCl(s)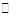 Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 |
| C.AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI) |
| D.硬水中含有较多的Ca2+、Mg2+、HCO3—、SO42—,加热煮沸可以完全除去其中的Ca2+、Mg2+ |
将适量AgBr固体溶在水中,溶液中存在AgBr(s)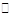 Ag+(aq)+Br-(aq)。则下列说法正确的是
Ag+(aq)+Br-(aq)。则下列说法正确的是
| A.向此体系中滴加足量浓NaCl溶液,发现沉淀转化为白色,说明Ksp(AgCl)<Ksp(AgBr) |
| B.向此体系中加入少量AgBr固体,平衡正向移动,当再次平衡时c(Ag+)、c(Br-)增大 |
| C.此体系中一定存在c(Ag+)=c(Br-)=[Ksp(AgBr)]1/2 |
| D.某溶液中c(Ag+)·c(Br-)=Ksp(AgBr),说明此时c(Ag+)=c(Br-) |
下列说法正确的是
A.已知2SO2(g)+ O2(g)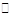 2SO3 (g),△H<0,该反应在任何温度下均可自发进行 2SO3 (g),△H<0,该反应在任何温度下均可自发进行 |
| B.0.01 mol·L-1NaHCO3溶液中c(Na+)= c(HCO3-)+ 2c(CO32-)+ c(H2CO3) |
| C.25℃,0.1mol·L-1 K2CO3溶液中c(H+)/ c(OH-) ="l.0" × l0-a,该溶液的pH=7+0.5a |
| D.室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1 AgNO3溶液,先生成Ag2CrO4沉淀 |
已知25℃时Mg(OH)2的Ksp为5.6×10-12mol3·L-3,MgF2的Ksp为7.4×10-11mol3·L-3。下列说法中正确的是
| A.25℃时,Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小 |
| B.25℃时,向Mg(OH)2的澄清饱和溶液中加入少量NH4Cl固体,c(Mg2+)减小 |
| C.25℃时,Mg(OH)2的溶解能力大于MgF2的溶解能力 |
| D.25℃时,饱和Mg(OH)2溶液与0.1mol·L-1NaF溶液等体积混合,能生成MgF2沉淀 |
下列说法正确的是
| A.两种难溶物中溶解度小的物质其KSP不一定小 |
| B.同种酸形成的酸式盐溶解度一定比正盐的溶解度大 |
| C.因为Ksp(BaSO4)= 1.08×l0-l0,Ksp(BaCO3)=8.1×10-9,所以BaSO4沉淀不可能转化为BaCO3沉淀 |
| D.相同温度下,将足量AgCl固体分别加入同体积的①0.1mo1·L-l盐酸、②0.1mo1·L-1氯化镁溶液、③0.1mo1·L-l l硝酸银溶液中,c(Ag+):③>②>① |